
- •Г.О.Сіренко, о.В.Кузишин, л.В.Базюк
- •Затверджено
- •Кузишин Ольга Василівна
- •Чому хемія, а не хімія?
- •Лекція 1 Фізична хемія як наука і предмет. Хемічна термодинаміка
- •1.1. Зв’язок та обумовленість фізичних та хемічних процесів
- •1.5. Фізична хемія розв’язує низку наукових проблем,
- •1.6. Фізична хемія розв’язує низку технічних проблем,
- •1.7. Основні розділи фізичної хемії як предмета
- •1.8. Методи фізичної хемії
- •Частина і. Хемічна термодинаміка
- •1. Науковий фундамент термодинаміки
- •2. Головними завданнями для хемічної термодинаміки
- •Лекція 2
- •. Термодинамічні системи та їх класифікація
- •2.2. Ґаз і па́ра. Ідеальний, неідеальний та реальний ґази
- •3. Ідеальний та неідеальний ґази
- •Параметри і функції термодинамічного стану
- •2.3.1.Загальні означення
- •Термодинамічні параметри стану та їх розмірности
- •2. Об’єм. Питомий об’єм
- •3. Кількість речовини
- •Внутрішня енергія
- •2.3.4. Ентальпія
- •2.3.5. Ентропія
- •4. Абсолютне значення ентропії
- •6. Для необоротніх процесів
- •2.3.6. Класифікація параметрів термодинамічного стану
- •Лекція 3
- •3.1. Термодинамічний процес і параметри термодинамічного процесу
- •3.1.1. Термодинамічний процес
- •3.1.1.1. Загальні означення
- •3.1.1.2. Види термодинамічних процесів
- •4. Графічне зображення політропних процесів
- •3.1.2. Параметри термодинамічних процесів
- •3.1.2.1. Робота як форма енергії
- •2. Робота. Означення і розмірність
- •Робота переміщення дорівнює термодинамічній роботі за вирахуванням зміни потенціяльної енергії тиску (p2v2 – p1v1):
- •3.1.2.2. Тепло як форма енергії
- •3.1.3. Загальні зауваги
- •3.2. Перше начало термодинаміки
- •3.2.1. Нульове начало термодинаміки (постулат)
- •3.2.2. Перше начало термодинаміки і форми запису
- •3.2.2.1. Формулювання першого начала
- •Або в диференціяльній формі:
- •Після диференціювання (3.59), будемо мати
- •3.3. Рівняння термодинамічного стану ґазів
- •3.3.1. Рівняння термодинамічного стану ідеальних ґазів
- •3.3.2. Рівняння термодинамічного стану реальних ґазів
- •Лекція 4
- •4.1. Теплоємність. Означення
- •4.1.1. Методи обчислення кількости тепла
- •1) Внутрішньої енергії
- •2) Ентальпії
- •3) Ентропії
- •4.1.2. Загальне означення теплоємности. Істинна і питома теплоємности
- •4.1.3. Обчислення кількости тепла за істинною і середньою теплоємностями
- •4.2. Ізобарна та ізохорна теплоємности. Рівняння Майєра
- •4.2.1. Зв’язок ізобарної та ізохорної теплоємностей
- •4.2.1.1. Рівняння Майєра для ідеального ґазу
- •1. Ізохорна та ізобарна теплоємности
- •2. Зв’язок між ізобарною та ізохорною теплоємностями
- •4.2.1.2. Рівняння Майєра для неідеального ґазу
- •4.3.Теорії теплоємностей твердих тіл
- •4.3.1. Молекулярно-кінетична теорія. Закон Дюлонґа і Пті
- •4.3.2. Квантова теорія Дебая
- •Лекція 5
- •5.1. Основні означення
- •5.2. Закон гесса
- •5.3.Розрахунок теплових ефектів
- •5.3.1. Розрахунок теплових ефектів хемічних реакцій за теплом утворення сполук
- •Наприклад, отримання при 25 ºС Al2(sо4)3 з кристалічного Аl2о3 (т) і ґазу sо3 за реакцією:
- •5.3.2. Тепловий ефект утворення сполуки певного аґреґатного стану (тепло аґреґатного стану)
- •5.3.3. Тепловий ефект утворення сполуки у розчині (тепло розчинення)
- •5.3.4. Тепло розведення розчину
- •5.3.5. Тепло взаємодії кислоти та основи
- •5.3.6. Розрахунок теплового ефекту хемічних реакцій за теплом згоряння
- •Лекція 6 друге начало термодинаміки. Цикл карно
- •6.1.Означення другого начала термодинаміки
- •6.2. Рівняння другого начала термодинаміки
- •6.3. Коефіцієнти ефективности термодинамічних циклів
- •6.3.1.Прямий цикл
- •6.3.2. Зворотній цикл
- •6.4. Цикл карно
- •6.4.1. Прямий цикл Карно
- •6.4.2. Зворотній цикл Карно
- •6.5. Математичні вирази другого начала термодинаміки
- •Термодинамічний процес (незамкнутий цикл).
- •7.1.Означення характеристичних функцій і термодинамічних потенціалів
- •7.2. Ентропія, внутрішня енергія і ентальпія як характеристичні функції
- •7.3. Ізохорно-ізотермний потенціал гельмгольца
- •7.4. Ізобарно-ізотермний потенціал ґіббса
- •7.5.Десять вислідів з попередньої частини лекції
- •7.6. Рівняння гельмгольца
- •7.7. Рівняння ґіббса
- •7.8.Рівняння ґіббса-гельмгольца
- •8.1. Залежність характеристичних функцій та ентропії від тиску. Фуґітивність
- •Стандартний стан
- •8.2. Хемічний потенціал
- •8.3.Хемічний потенціал ідеального ґазу
- •8.4.Хемічний потенціал реального ґазу
- •Лекція 9
- •9.1. Активність реальних ґазів і розчинів
- •9.1.1. Активність реального ґазу
- •9.1.2. Активність компонентів розчину
- •9.2. Хемічна рівновага
- •9.2.2. Рівняння рівноваги для суміші ідеальних ґазів і константа рівноваги
- •9.2.3. Рівняння рівноваги для ідеального розчину і константа рівноваги
- •9.2.4.Рівняння рівноваги для суміші реальних ґазів і константа рівноваги
- •9.2.5. Рівняння рівноваги для неідеальних розчинів і константа рівноваги
- •9.2.6. Закон діяння мас Ґульдберґа-Воґе
- •9.3.Рівняння ізотерми і напрямок хемічної реакції
- •Для ідеального розчину
- •Для суміші реальних ґазів
- •9.4.Стандартний потенціал ґіббса хемічної реакції Введемо поняття стандартного потенціалу Ґіббса і знайдемо його зв’язок з константами рівноваги хемічної реакції:
- •Для суміші ідеальних ґазів
- •Для ідеального розчину
- •Для неідеального розчину
- •9.5. Константа рівноваги і стандартний потенціал ґіббса хемічної реакції
- •9.6.Константа рівноваги і способи вираження складу реакційної суміші
- •9.7.Вплив тиску на рівновагу хемічної реакції. Принцип зміщення рівноваги ле шательє-брауна
- •Приклади
- •9.8. Гетерогенна хемічна рівновага
- •9.9.Залежність константи рівноваги від температури. Рівняння ізобари та ізохори хемічної реакції
6.4.2. Зворотній цикл Карно
Схема зворотнього циклу Карно в Т-S (а) і p-V (б) координатах показана на рис. 6.6. Тут лінії 1→2 і 3→4 відповідають двом оборотнім адіабатам, а 2→3 і 4→1 – двом оборотнім ізотермам.
Площа F15641 чисельно дорівнює відведеній від Р.Т. до ВДТ кількости тепла Q1 при ізотермному (Т1=const) стиску, площа F56325 – підведеній до Р.Т. від НДТ кількости тепла Q2, а площа F12341 – кількости тепла циклу Q0 (рис. 6.6а). Площа F51265 чисельно дорівнює роботі адіабатного (S1=S2=const) процесу розширення, площа F62386 – роботі ізотермного (Т2=const) процесу розширення, площа F83478 – роботі адіабатного (S3=S4=const) процесу стиску, площа F74157 – роботі ізотермного (Т1=const) процесу стиску, а площа F12341 – роботі циклу L0 (рис. 6.6б).
|
|
Рис. 6.6. Схема зворотнього циклу Карно в Т-S (а) і p-V (б) координатах
Враховуючи вираз (6.57) термічний холодниковий коефіцієнт корисної дії зворотнього циклу Карно дорівнює:
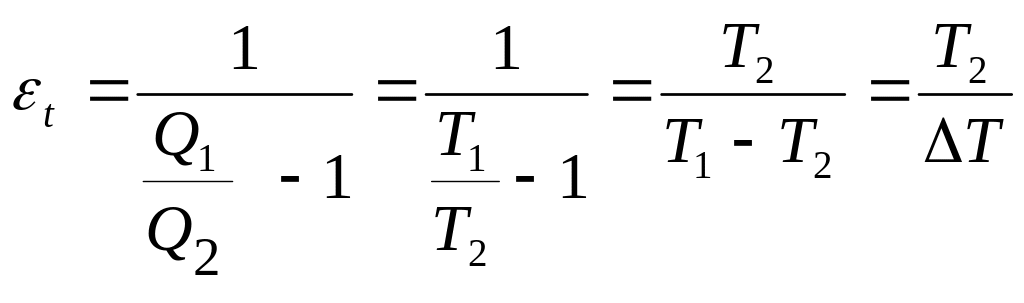 ,
(6.59)
,
(6.59)
при цьому
><1. (6.60)
6.5. Математичні вирази другого начала термодинаміки
Для прямого циклу Карно (як для оборотнього циклу) правдиві співвідношення:
 (6.61)
(6.61)
звідки
![]() (6.62)
(6.62)
а враховуючи, що підведене тепло (Q1) має знак «+», а відведене тепло (Q2) має знак «–», запишемо
 (6.63)
(6.63)
тоді
![]() (6.64)
(6.64)
або в загальному вигляді:
![]() (6.65)
(6.65)
тобто сума зведених теплот прямого циклу Карно дорівнює нулю.
Для прямого необоротнього циклу за структурою Карно, у якому принаймні одна ділянка циклу є необоротньою, правдиві співвідношення:
 <
<![]() (6.66)
(6.66)
Аналогічно (6.61)-(6.64) запишемо
![]() <0,
(6.67)
<0,
(6.67)
або в загальному вигляді:
![]() <0,
(6.68)
<0,
(6.68)
тобто сума зведених теплот прямого необоротнього циклу за структурою Карно менше нуля.
Розглянемо підхід Клаузіуса для математичного опису довільного циклу.
Н
 ехай
довільний цикл 12341 має вигляд (рис.
6.7).
ехай
довільний цикл 12341 має вигляд (рис.
6.7).

Рис. 6.7. Довільний цикл
Нехай цей цикл оборотній. Розіб’ємо цикл N-множиною оборотніх ізотерм (Ті=const) і N-множиною оборотніх адіабат (Sі= const). То в граничному випадку (N→∞) отримаємо безкінечну множину циклів Карно. Для елементарного циклу Карно сума зведених елементарних теплот дорівнює нулю:
![]() (6.69)
(6.69)
для N-циклів
![]() (6.70)
(6.70)
у граничному випадку (N→∞)
![]() (6.71)
(6.71)
що рівноцінно виразу (перший інтеґрал Клаузіуса) для оборотнього довільного циклу:
![]() (6.72)
(6.72)
Аналогічно для необоротнього довільного циклу
![]() <0,
(6.73)
<0,
(6.73)
що рівноцінно виразу (другий інтеґрал Клаузіуса) для необоротнього довільного циклу:
![]() <0.
(6.74)
<0.
(6.74)

