
- •152Г фторда неше эквиваленттік молярлы массасы болады:
- •Кальций гидроксидінің эквиваленттік массасы (г/моль) мынаған тең:
- •37 Г кальций гидроксидіндегі (г/моль)молекула санын есептеңдер:
- •Алу әдісінен тәуелсіз, химиялық қосылыстар толықтай белгілі және тұрақты құрамға ие бола алады:
- •С. Құрам тұрақтылық заңы
- •Де Бройль теңдеуі:
- •Вf3 молекуласындағы бор атомының валентті орбитальдары мына тип бойынша гибридтелген:
- •А. Бағытталғандық және қаныққандық
- •Жартылайөткізгіш мембрана арқылы еріткіш молекулаларының біржақты диффузиясы төмендегідей аталады:
- •Е. Тепе-теңдікке ұмтылу
А. Бағытталғандық және қаныққандық
B. қаныққандық және полюстену
C. полюстену
D. қаныққандық
Е. байланыс энергиясы
$$$C
Су молекуласының ассоциация түзүі төмендегі қасиеттермен түсіндіріледі :
А. байланыстың қанықпауы
B. ковалентті байланыстың түзілуімен
C. сутектік байланыстың түзілуімен
D. молекуланың полюстілігімен
Е. оттегінің электртерістілігімен
$$$C
Бас және орбиталь квант сандарының суммасы (n+l=5) беске тең болатын орбитальді көрсет:
3s
3p
3d
4d
Е. 4f
$$$B
Ядросында 19 протоны және 20 нейтроны бар элементтің атомдық массасын анықта:
19
39
20
38
Е. 40
$$$D
Оттегі атомындағы орбитальдар санының суммамсы мыныған тең :
2
3
4
5
Е. 6
$$$A
Ионизациялану энергиясы ядро зарядының өсуімен элементтер қатарында жоғарыдан төмен қарай:
А. кемиді
B. артады
C. өзгермейді
D. негізгі қатарларда артады
Е. заңдылық жоқ
$$$D
Электрондық аналогтар болатын элементтерді көрсет:
N,P,S,CI
O,S,CI
S,CI,Ar
N,P,As
Е. O,S,N
$$$D
Байланысқа атомдық орбитальін беретін атом төмендегідей аталады:
катион
анион
C. донор
D. акцептор
Е. ион
$$$C
Ең төмен энергиялы орбитальді көрсет:
A. 3s
B. 3p
C. 2p
D. 3d
Е. 4s
$$$A
Екінші ретті периодтылық деп:
A. топшалардағы элементтер қасиеттерінің монотонды емес өзгеруі
B. топшалардағы элементтер қасиеттерінің монотонды өзгеруі
C. топтардағы металдық қасиеттердің өзгеруі
D. топшалардағы бейметалдық қасиеттердің өзгеруі
Е. бұл түсініктің мәні жоқ
$$$A
Негізгі топшаларды құрайтын элементтер:
А. s және р-элементтер
B. s және d-элементтер
C. s және f-элементтер
D. р және d-элементтер
Е. р және f-элементтер
$$$E
Химиялық байланыстың түзілуі кезінде қандай энергетикалық эффект орын алады:
А. энергия сіңірілуі
B. энергия өзгермейді
C. заңдылық жоқ
D. тек қана иондық байланыс түзілуі кезінде
Е. энергия бөлінеді
$$$E
Төмендегі байланыстардың қандай типіне неғұрлым жоғары энергия тән:
А. ковалентті
B. ковалентті полюсті
C. ковалентті полюссіз
D. металлдық
Е. иондық
$$$B
Иондық байланыстың қасиеттерін көрсет (толық жауапты таңдау қажет):
1. қаныққандық, 2. бағытталғандық, 3. қанықпағандық, 4. бағытталмағандық, 5. полюстену.
A. 1,2
B. 3,4,5
C. 4,5
D. 1,2,5
Е. 1,3,5
$$$D
Қозбаған күйдегі атомнан электронды жұлып алуға жұмсалатын энергия төмендегідей аталады:
A. электрон тартқыштық
B. электртерістілік
C. байланыс энергиясы
D. бірінші ионизациялану энергиясы
Е. электроңдылық
$$$B
Бір атомның электрон жұбы және екінші бір атомның бос орбитальдарының әрекеттесуі нәтижесінде түзілетін химиялық байланыс төменднгідеі аталады:
A. ковалентті полюсті
B. ковалентті байланыстың донорлық-акцепторлық механизмі
C. иондық
D. металлдық
Е. ковалентті полюссіз
$$$E
Қосымша топшалар құрамына кіретін элементтер:
A. s-элементтер
B. р-элементтер
C. s- және р-элементтер
D. s- және d-элементтер
Е. d-элементтер
@@@ Химиялық процесстердің энергетикасы.Химиялық кинетика,химиялық тепе-теңдік
$$$B
Қоршаған ортамен энергиясымен және заттарымен алмасатын жүйе:
A. оқшауланған жүйе деп аталады
B. ашық жүйе деп аталады
C. жабық жүйе деп аталады
D. гомогенді жүйе деп аталады
E. гетерогенді жүйе деп аталады
$$$B
Мына реакцияда FeS+HNO3Fe(NO3)2+S+NO2+H2O
неше моль HNO3 (конц.) қатысады:
А. 10
В.4
С.8
D.7
Е.6
$$$C
Мына реакция үшін 2HF+O3H2O+F2+O2 Гибсс энергиясы
(кДж/моль) GHF= -269,9 кДж/моль; GHO= -237,3 кДж/моль:
А. –252,4
В.139,3
С.302,5
D.5,7
Е.14,3
$$$C
Мына реакция үшін 2HF+O3H2O+F2+O2 Гибсс энергиясы
(кДж/моль) GHF= -269,9 кДж/моль; GHO= -237,3 кДж/моль:
А. –252,4
В.139,3
С.302,5
D.5,7
Е.14,3
$$$B
Егер оттегінің концентрациясын 3 есе арттырса, мына реакция-
ның 4HCl + O2 = 2 Cl2 + 2H2 жылдамдығы қалай өзгереді?
А. 7 есе артады
В. 3 есе артады
С. 3 есе азаяды
D. 6 есе артады
Е. 5 есе артады
$$$D
Мына реакция үшін 2А + 2В = С әрекеттесетін заттардың біреуінің концентрациясын 3 есе арттырса, ал температураны 300С – қа төмендетсе ( 2), реакция жылдамдығы қалай өзгереді?
А. 2 есе артады
В. 3 есе азаяды
С. 8 есе азаяды
D. 1,1 есе артады
Е. 4 есе кемиді
$$$B
Егер оттегінің концентрациясын 3 есе арттырса, мына реакция-
ның 4HCl + O2 = 2 Cl2 + 2H2 жылдамдығы қалай өзгереді?
А. 7 есе артады
В. 3 есе артады
С. 3 есе азаяды
D. 6 есе артады
Е. 5 есе артады
$$$B
Мына тепе- теңдекті оңға ығыстыру үшін FeO + H2 = Fe + H2O(г)
А. FeO және H2 концентрацияларын көбейтеді
В. Н2 концентрациясын және қысымын көбейтеді
С. Реакция нәтижесінде түзілген заттардың концентрациясын
көбейтіп
D. FeO концентрациясын көбейтіп
Е. Н2О концентрациясын көбейтіп
$$$C
Егер қысымды арттырса, мына тепе-теңдік қай жаққа ығысады:
СО(г) + Н2О(г) = СО2 (г) + Н2 (г)
А. оңға
В. солға
С. тепе-теңдік бұзылмайды
D. дұрыс жауабы жоқ
Е. оңға, сосын солға
$$$C
H2 + I2 2HI реакциясы үшін мына концентрацияларда
Н2 = 0,3 моль/л ; I2 = 0,08 моль/л; HI = 0,35 моль/л тепе-
теңдік орнаған. Тепе-теңдік константасын есепте.
А. 14,59
В.18,24
С.36
D. 0,08
Е.5,1
$$$B
Түзілу энтальпиясы нольге тең заттар:
A. НСІ, СО
B. О2, СІ2
C. СН4, СаО
D. РН3, КОН
E. НІ, Na2O
$$$D
Химиялық термодинамика нені зерттейді:
A. реакция ретін
B. реакция жылдамдығын
C. реакцияның молекулалығын
D. реакция энергиясының өзгеруін
E. қайтымсыз реакцияларды
$$$B
Гиббс энергиясының өзгеруі қай формуламен есептеледі:
A. G = T G
B. G = H - TS
C. G = T S - H
D. G = H
E. G = H + S
$$$A
Қоршаған ортамен тек қана энергиясымен алмасатын жүйе :
A. жабық жүйе деп аталады
B. ашық жүйе деп аталады
C. оқшауланған жүйе деп аталады
D. гомогенді жүйе деп аталады
E. қайтымды жүйе деп аталады
$$$B
Оқшауланған жүйелерде өздігінен жүретін процесстер мына бағытта жүреді:
A. энтропияның төмендеуі
B. энтропияның жоғарылауы
C. энтропияның нольге ұмтылуы
D. энтропияның біртексіз өзгеруі
E. энтропияның өзгеруінде заңдылық жоқ
$$$B
Мына реакцияға (аА + вВ = сС + дД) массалар әсер заңының математикалық теңдеуі қалай өрнектелген:
A. Р = CRT
B. v = k CaA . CвВ
C. tзам = K . Cm
D. tкип = E . Cm
E. E = h v
$$$E
Температураны 200 ( =2) төмендетсе , реакция жылдамдығы да төмендейді:
A. 2 есе
B. 6 есе
C. 8 есе
D.16 есе
E. 4 есе
$$$D
Мына реакция (Н2+СІ2 =2НСІ) жүретін жүйеде қысымды 2 есеге арттырған. Реакция жылдамдығы неше есе артады :
A. 3 есе
B. 6 есе
C. 8 есе
D. 4 есе
E. 27 есе
$$$B
Тепе-теңдік константасын қай формуламен есептейді:
A. К = kпр. + kобр.
B. K = kпр. /kобр.
C. K = kпр. kобр.
D. K = kпр. – kобр.
E. K = kобр.
$$$A
Мына реакцияда (N2+3H2 = 2NH3) қысымның төмендеуіне байланысты реакция тепе-теңдігі қай жаққа ығысады:
A. солға
B. оңға
C. ешқайда ығыспайды
D. заңдылық жоқ
E. тепе-теңдік орнамайды.
$$$E
Реакция жылдамдығына әсер етпейтін фактор:
A. концентрация
B. температура
C. катализатор
D. әрекеттесетін заттар табиғаты
E. көлем
$$$D
Температураны 300 жоғарылатқанда реакция жылдамдығы 8 есе артты. Температуралық коэффициентті есепте:
A. 9
B. 8
C. 6
D. 2
E. 1
$$$D
Мына реакцияда (N2+3H2 = 2NH3+ 92,0 кДж,) тепе-теңдікті аммиак түзілу жағына қарай ығыстыру үшін не істеу керек:
A. қысыммен температураны төмендету керек
B. қысымды төмендетіп, ал температураны жоғарылату керек
C. қысымды да, температураны да жоғарылату керек
D. қысымды жоғарылатып, ал температураны төмендету керек
E. сутегінің корнцентрациясын төмендету керек
$$$E
Мына реакцияда (2NOг. +O2 г. = 2NOг.) қысымның 2 есе жоғарылауымен байланысты реакция жылдамдығы:
A. 6 есе артада
B. 6 есе кемиді
C. 8 есе артады
D. 16 есе кемиді
E. 27 есе артады.
$$$D
Қай жағдайда тепе-теңдік орнайды:
A. vпр. = vобр. G O
B. vпр. vобр. G = O
C. vпр. vобр. G O
D. vпр. = vобр. G = O
E. vпр. = vобр. H O
$$$C
Гомогенді реакцияның жылдамдық константасы осы реакцияның сандық мәніне қандай жағдайда тең болады:
A. егер әректтесуші заттар концентрациясы нөльге тең болса
B. катализатора қатысында
C. егер әрекеттесуші заттар концентрациясы 1 моль/л тең болса
D. егер t = 2980 K
E. егер Еакт. = 1.
$$$A
Температураны әрбір 100 көтерген сайын, Вант-Гофф ережесі бойынша реакция жылдамдығы неше есе артады:
A. 2-4 есе
B. 15-18 есе
C. 12-14 есе
D. 5-7 есе
E. 2-8 есе
$$$D
Жүйедегі температураны ( =2 ) 200 –тан 400-қа дейін көтерді, реакция жылдамдығы неше есе артты:
A. 32 есе
B. 16 есе
C. 12 есе
D. 4 есе
E. 2 есе
$$$C
Мүмкін болатын термодинамикалық реакцияның жылдамдығын өзгертіп, ал бірақ өздері реакция барысында өзгеріссіз қалатын заттар :
A. индикаторлар деп аталады
B. регуляторлар деп аталады
C. катализаторлар деп аталады
D. промоторлар деп аталады
E. константалар деп аталады
$$$E
Тепе-теңдік жағдайда тұрған жүйеге қандай да бір жағдаймен әсер етсе ( мысалы t, Р,C-ны өзгертсе), онда тепе-теңдік осы әсерді әлсірететін бағытқа қарай ығысады. Бұл заң:
A. массалар әсер заңы
B. зат массасының сақталу заңы
C. энергия сақталу заңы
D. Гесс заңы
E. Ле-Шателье принципі
$$$B
Химиялық реакция нәтижесінде бөлінетін немесе сіңірілетін жылу :
A. жүйенің ішкі энергиясы деп аталады
B. реакцияның жылу эффектісі деп аталады
C. жүйенің энтропиясы деп аталады
D. Гиббс энергиясы деп аталады
E. жуйенің кинетикалық энергиясы деп аталады
$$$E
Жүйенің энтальпиясы арта жүретін химиялық реакциялар қалай аталады:
A. нейтралдай реакциясы
B. алмасу реакциясы
C. тотығу-тотықсыздану реакциясы
D. экзотермиялық реакциялар
E. эндотермиялық реакциялар
$$$D
Қоршаған ортамен энергиясымен және массасымен ауысатын жүйе төмендегідей аталады:
А. гомогенді
B. жекеленген
C. гетерогенді
D. ашық
Е. тұйық
$$$D
Химиялық реакциы жылдамдығы немен анықталады:
A. әрекеттесетін заттардың моль санымен
B. бөлшектердің соқтығысу санымен
C. бөлшектердің активті соқтығысу санымен
D. бір көлемде бір уақыт ішінде реакцияға қатысатын заттардың моль с.нымен
Е. реакция өнімінің моль санымен
$$$B
Вант-Гофф заңы бойынша осмостық қысым төмендегіге тура пропорционал:
А. зат эквивалентіне
B. молярлы концентрацияға және температураға
C. электрөткізгіштікке
D. процентті концентрацияға
Е. иондар қозғалғыштығына және температураға
$$$D
Ішкі энергия, энтальпия, энтропия, температура нені білдіреді:
А. энергетикалық сипаттамалар
B. ауыспалы қасиеттер
C. заттардың тұрақты қасиеттері
D. күй функциясы
Е. жекеленген жүйені сипаттайтын шамалар
$$$A
Реакцияның молекулярлығы деп нені атайды:
А. реакцияның элементарлы актіне қатысатын молекулалар саны
B. реакция нәтижесінде түзілген молекулалар саны
C. соқтығысқан молекулалар саны
D. әрекеттесуші заттар және реакция өнімі молекулаларының санының суммасы
Е. бұл реакция тәртібі
$$$D
Түзілу энтальпиясының стандартты мәніне сүйене отырып, неғұрлым тұрақты қосылысты көрсет:
A. Н0AgCl=-127,1 кДж/моль
B. Н0Н2О=- -285,8 кДж/моль
C. Н0НCl=-92,3 кДж/моль
D. Н0AL2O3=-1676 кДж/моль
Е. Н0Al=-0 кДж/моль
$$$C
Химиялық тепе-теңдіктің ығысуына не әсер етпейді:
A. зат концентрациясы
B. температура
C. катализатор
D. қысым
Е. қысым және концентрация
$$$C
Химиялық реакция жылдамдығы неге тәуелсіз:
A. концентрацияға
B. температураға
C. катализаторға
D. рітінді көлеміне
Е. әрекеттесуші заттар табиғатына
$$$C
Тұрақты температурадағы қайтымсыз процесстер үшін термодинамиканың ІІ заңының математикалық теңдеуін көрсет:
Е.
![]()
$$$C
Катализді қай жағдайда гомогенді деп атайды:
A. әрекеттесуші заттар және катализатор - газдар
B. әрекеттесуші заттар және катализатор - сұйықтықтар
C. әрекеттесуші заттар және катализатор бір фазада
D. әрекеттесуші заттар және катализатор әртүрлі фазада
Е. катализатор қатты зат
$$$B
Жекеленген жүйедегі процесстер төмендегі бағыт бойынша өздігінен жүре бастайды (термодинамиканың ІІ заңы):
A. энтропияның кемуі
B. энтропияның артуы
C. энтропия нөлге тең
D. энтропи үнемі өзгеріп отырады
Е. энтропияның біртіндеп кемуі
$$$E
Мына процессте хлор шығымын қалай көбейтуге болады:
4НСl(г) + О2 (г) 2Сl2 (г) + 2Н2О(г)
A. оттегі концентрациясын кеміту
B. температураны арттыру
C. қысымды азайту
D. қысымды азайту және температураны арттыру
Е. қысымды арттыру
$$$D
Реакция жылдамдығының константасы төмендегіге тәуелді:
A. концентрацияға
B. концентрацияға, температураға
C. концентрацияға және реагенттер табиғатына
D. температураға, әрекеттесуші заттар табиғатына
Е. еріткіш табиғатына
$$$D
Кальций фосфаты, кальций оксиді, фосфорлы ангидрид қосылыстарының түзілу жылуы Н0298 осыған сәйкес: -4137,5 кДж/моль, -635,5 кДж/моль, -1492 кДж/моль. Реакцияның жылу эффектісін есепте:
3 СаО(к) + Р2О5(к) = Са3(РО4)2 (к)
–3502кДж
–2127кДж
–2010,5кДж
–739кДж
Е. +739кДж
$$$C
Егер температураны 300С –қа көтергенде, реакция жылдамдығы 27 есе артқан, реакцияның температуралық коэффициентін анықта:
9
2
3
2,7
Е. 2,2
$$$B
Реакцияның температуралық коэффициенті төмендегі мәндерді қабылдай алады:
A. 10-нан 100-ге дейін
B. 2-ден 4-ке дейін
C. 2-ден 10-ға дейін
D. 0-ден 4-ке дейін
Е. 0-ден 10-ға дейін
$$$C
Катализатор төмендегілердің қайсысына әсер етпейді:
A. реакция жылдамдығына
B. реакция энергиясының активациясына
C. реакцияның жылу эффектісіне
D. әрекеттесуші заттар концентрациясына
Е. кері реакция жылдамдығына
$$$B
Күй функциясына тән қасиеттер:
A. ауыспалы мән
B. өзгеріс өту жолына тәуелсіз
C. жағдайға тәуелді белгілі бір мән
D. өзгеріс уақыт ішінде үздіксіз
Е. тұрақты мән
$$$E
Қысымды 2 есе арттырғанда тура реакция жылдамдығы 2СО(Г)=СО2(Г)+С(ТВ) төмендегідей өзгереді:
A. 2 есе артады
B. 3 есе артады
C. 4 есе азаяды
D. 6 есе артады
Е. 4 есе артады
$$$D
Молекуланың немесе ионның активтілігі деп:
A. ион немесе молекула энергиясы
B. олардың концентрациясы
C. реакцияға қатыса алу қабілеті
D. олардың химиялық реакцияда соған сәйкес әсер ететін концентрациясы
Е. заттар концентрациясы
$$$B
Гиббстің еркін энергиясы төмендегі қатынаспен анықталады:
H=U+PV
B. G=H-TS
H=q
D.
S=
![]()
Е. S
$$$A
Тұрақты қысымда, химиялық реакцияларда сіңірілетін немесе бөлінетін жйлу өлшемі қалай аталады:
A. энтальпия
B. энтропия
C. Гиббстің еркін энергиясы
D. потенциал
Е. энергия
$$$B
3,2г күкірт жанғанда 27,9 кДж жылу бөлінеді, SO2 түзілу
жылуын есепте (кДж):
А. 27,9
В. 279
С. 87,64
D.6,9
Е. 4,6
$$$C
80г Fe2O3 көміртегі (ІІ) оксидімен толық тотықсызданғанда
13,4 кДж энергия бөледі, Fe2O3 – тің Н298 есепте:
А. –13,4
В.13,4
С.-26,8
D. 52,8
Е.70
@@@ Ерітінділер. Ерітінділер концентрациясы. Электролиттік диссоциация. Тұздар гидролизі
$$$E
Ерітіндіге дәл анықтама беріңдер:
A. еріген зат және еріткіштен тұратын жүйе
B. гомогенді жүйе
C. гетерогенді жүйе
D. еріген заты бар жүйе
Е. екі немесе оданда көп компоненттері бар және олардың әрекеттесуі нәтижесінде түзілген өнімдері бар ,гомогенді жүйе
$$$B
200 мл 0,1М ерітіндідегі күкіт қышқылының құрамы төмендегідей (граммен):
1,5г
1,96г
2,5г
9,8г
Е. 4,5г
$$$A
Моляльді концентрация төмендегі мәндермен анықталады:
A.100 г ерітіндідегі заттардың грамм санымен
B.1 л ерітіндідегі заттардың моль санымен
C.1 л ерітіндідегі заттардың грамм санымен
D.1 л ерітіндідегі моль-эквиваленттер санымен
Е.1 кг еріткіштегі заттардың моль санымен
$$$D
Таза еріткішпен салыстырғанда ерітіндінің қайнау температурасының артуы, қату температурасының азаюы төмендегіге тура пропорционал:
A. қысымға
B. нормальді концентрацияға
C. еріткіштің диэлектрлік өткізгіштігіне
D. ерітіндінің моляльді концентрациясына
Е. процентті концентрацияға
$$$B
Криоскопиялық және эбулиоскопиялық константалар темендегіге тәуелді:
A. температураға
B. еріткіш табиғатына
C. еріген зат табиғатына
D. температура және концентрацияға
Е. еріген зат және ерітінді табиғатына
$$$B
Оствальдтың сұйылту заңы:
B.![]()
C.![]()
D.
![]()
Е. С=kp
$$$A
Гидролиз константасы төмендегіден тәуелсіз:
A. тұз концентрациясынан
B. температурадан
C. тұз табиғатынан
D. тұз табиғатынан және температурадан
Е. температура артуынан
$$$D
Сутек иондарының концентрациясы 1*10-5М .Ерітіндінің рН-ын анықта:
0,1
7
9
5
Е. 2,8
$$$C
Қай еріткіште заттардың электролиттік диссоциация орын алады:
А. СН3СООН (=6,2)
B. НСООН (=5,3)
C. Н2О (=78)
D. С6Н6 (=2,3)
Е. СНСl3 (=5,1)
$$$B
200 мл 0,1М ерітіндідегі күкіт қышқылының құрамы төмендегідей (граммен):
1,5г
1,96г
2,5г
9,8г
Е. 4,5г
$$$E
Ерітіндіге дәл анықтама беріңдер:
A. еріген зат және еріткіштен тұратын жүйе
B. гомогенді жүйе
C. гетерогенді жүйе
D. еріген заты бар жүйе
Е. екі немесе оданда көп компоненттері бар және олардың әрекеттесуі нәтижесінде түзілген өнімдері бар ,гомогенді жүйе
$$$A
450г суда 50 г тұзды ерітті. Тұздың ерітіндідегі массалық үлесін (%) анықтаңдар:
A. 10%
B. 5%
C. 50%
D. 1%
Е. 2%
$$$C
Нейтрал ортадағы сутек иондарының концентрациясы төмендегіге тең:
7*10-7
14
1*10-7
7
Е. 10-14моль/л
$$$C
Na3РО4 тұзының гидролизі кезінде түзілетін заттарды көрсет:
A. Н3РО4 және NаОН
B. NаН2РО4 және NаОН
C. Nа2НРО4 және NаОН
D. Nа2НРО4 және NаН2РО4
Е. Н3РО4 және Nа2НРО4
$$$C
Сутегі ионының концентрациясы Н+=10-3 моль/л. рОН нешеге тең?
A. 3
B. 6
C. 11
D. 7
Е. 2,7
$$$A
Na3PO4 ерітіндісінің реакция ортасы қандай?
А. сілтілік
В. қышқылдық
С. нейтрал
D. әлсіз қышқылдық
Е. газды
$$$D
HNO2 үшін диссоциациялану константасының дұрыс мәні:
А. K = HNO2/H+NO2-
B. K = NO2-/HNO2
C. K = H+/HNO2
D. K = H+NO2-/HNO2
E. K = HNO2/NO2-
$$$B
1000мл ерітіндіде 8г натрий гидроксиді бар, молярлық концентрациясын есепте:
А. 0,1М
В. 0,2М
С.0,3М
D. 0,5М
Е.1М
$$$A
Галогенсутекті қышқылдардың қайсысы әлсіз электролит:
А. HF
B.HCl
C. HBr
D.HI
E. HAt
$$$A
500мл 0,1М калий дихромат ерітіндісін дайындау үшін қанша тұз алу керек (г):
А. 14,7
В. 294
С.29
D. 50
Е.98
$$$D
200мл 1,96г күкірт қышқылы ерітілген болса, ол ерітінді неше нормальді?
А. 14,7
В. 0,1
С. 0,5
D. 0,2
Е. 0,7
$$$A
NH4Cl тұзының гидролизі кезіндегі реакция ортасын көрсет:
рН 7
B. рН7
C. рН=7
D. рН=10
Е. рН8
$$$B
Гидролизге ұшырайтын тұздарды көрсет:
A. NaNO3, K2SO4
B. AlCl3, Na2S
C. KCl
D. NaCl
Е. NaCl, BaCl2
$$$E
200 мл ерітіндіде 4 г натрий гидроксиді бар. Ерітіндінің молярлы концентрациясын тап:
A.0,1М
0,2 М
0,3 М
0,4 М
Е. 0,5 М
$$$E
Na2S ерітіндісінің ортасы:
А. қышқылдық
В.негіздік
С. нейтрал
D. дұрыс жауабы жоқ
Е. сілтілік
$$$B
10г кальций сульфатымен 80 мл судан дайындалған ерітіндінің массалық үлесі (% концентрациясы) қанша:
А. 10%
В. 11,1%
С. 80%
D. 8,8%
Е. 0,1%
$$$B
Концентрациясы 0,1 моль/л натрий гидроксидінің рН-ы:
А. 14
В.13
С. 12
D. 0,1
Е. 11
$$$B
Егер ерітіндінің рН=10 болса, гидроксид-ионының концентра-
циясы:
А. 10-2
В. 10-4
С. 10-10
D. рОН=4
Е.10-6
$$$D
Егер натрий карбонаты І-саты бойынша гидролизге ұшыраса,
гидролиз дәрежесі қанша (КД= 5*10-11) СМ= 0,00125 моль/л?
А. 6*10-2
В.4*10-6
С.2*10-3
D.2*10-4
Е. 5*10-6
$$$B
10%-ті 800 мл ерітіндіде (=1,10 г/мл) неше грамм FeSO4
ерітілген:
А.8,8
В.88
С.80
D.40
Е.55
$$$B
7,5 г алюминий сульфаты 250 мл ерітіндіде болса, оның нор-
мальды концентрациясын анықта:
А. 0,088
В.0,528
С.0,1
D.0,637
Е.0,215
$$$B
10 г калий сульфаты мен 80 мл судан дайындалған ерітіндінің
массалық үлесі (%-тік концентрациясы) қанша?
А. 10
В.11,1
С.80
D.8,8
Е.5,4
$$$C
CaCO3 тұзының ерігіштігін (г/л) есепте (ЕК=4,4*10-4):
А. 15,08
В.7*10-3
С.2,0976
D.4,4*10-4
Е.4,4*10-10
$$$B
Егер 18г H2SO4 282 мл суда еріген болса, ерітінді концентра-
циясы:
А.5%
В.6%
С. 8%
D. 10%
Е.12%
$$$A
0,5М сахароза ерітіндісінің осмостық қысымы 270С (R=0,082) градуста төмендегі мәнге тең:
12,3 атм
1,23 атм
C. 8,2 атм
D. 1,5 атм
Е. 16,4 атм
$$$A
220г суда 30г натрий хлориді ерітілсе, тұздың массалық
үлесі (%) қандай?
А. 12г
В.10г
С.5г
D.15г
Е.6г
$$$A
20 мл күкірт қышқылымен толық нейтралдау реакциясына
түсуге 0,1 N калий гидроксидінің 24 мл жұмсалған болса, күкірт
қышқылының нормальды концентрациясы:
А. 0,12
В.0,4
С.0,1
D.0,05
Е.0,06
$$$D
80г 15% ерітіндіге 20г су қосылды, осы ерітінді
концентрациясы (%):
А.24
В.10
С.15
D.12
Е.6
$$$E
Егер 200 мл ерітіндіде 2,52г марганец (ІІ) хлориді еріген болса, оның молярлы концентрациясы қандай?
А.0,2
В.0,3
С.0,05
D. 0,3
Е.0,1
$$$A
Егер натрий гидроксидінің массалық үлесі 12% болса, оның 1л
ерітіндісін дайындау үшін неше грамм NaOH алу керек ( 1,137 г/мл):
А. 136,44г
В. 13,644г
С. 62,72г
D. 40г
Е. 19г
$$$C
Молярлы концентрациясы 0,3 моль/л 400мл ерітінді дайындау
үшін неше грамм калий хлоридін алу керек:
А. 10
В.18
С.8,94
D. 4,65
Е.15
$$$B
7,5 г алюминий сульфаты 250мл ерітіндіде болса, оның нор-
мальды концентрациясын анықта:
А. 0,088
В. 0,528
С.0,1
D. 0,632
Е. 0,56
$$$C
Егер құмырсқа қышқылының КД= 1,8*10-4 болса, концентрациясы 0,1 моль/л () диссоциация дәрежесі қанша?
А. 6,0%
В. 3%
С. 4,2%
D.2,6%
Е.3,9%
$$$B
15% ерітінді алу үшін 100мл 40% натрий гидроксидіне ( 1,437 г/см3) қанша су құю керек (мл):
А. 200
В. 240
С. 100
D. 150
Е. 180
$$$A
500мл 0,1М калий дихроматы ерітіндісін дайындау үшін қанша тұз алу керек:
А. 14,7
В. 294
С. 29
D. 50
Е. 35
$$$C
200мл ерітіндіде 1,96г күкірт қышқылы ерітілген болса, ол ерітінді неше нормальды:
А. 0,1
В. 0,5
С. 0,2
D. 0,7
Е. 0,05
$$$A
Алюминий сульфатының 2 молекуласы диссоциацияға
ұшыраса, неше анион пайда болады?
А.6
В.2
С.4
D.5
Е.7
$$$A
2л 0,1N азот қышқылының ерітіндісінде неше грамм қышқыл бар:
А. 12,6
В.63
С.6,3
D.126
Е.56
$$$C
Егер Н+ = 10-5 моль/л болса, ОН- қанша?
А. 10-14
В.2*10-5
С.10-9
D.10-8
Е.10-15
$$$B
Егер Н+ = 10-6 моль/л болса, рОН қанша?
А. 10-6
В.8
С.14
D.10-8
Е.12
$$$D
Әлсіз бір негізді 0,2N қышқылдың диссоциация дәрежесі 0,03 болса, Н+ қанша?
А. 0,2
В.6*10-8
С. 6*10-1
D.6*10-3
Е.6*10-9
$$$A
Әлсіз бір негізді 0,2N қышқылдың диссоциация дәрежесі 3% болса, OН- қанша?
А. 6*10-3
В.4*10-2
С. 1,7*10-12
D.6*10-6
Е.6*10-8
$$$C
0,0365% тұз қышқылының ( 1г/см3) рН есепте:
А.4
В.0,1
С. 2
D.0,0365
Е.3
$$$C
Гидролизге ұшырайтын тұз:
А. NaCl
B.K2SO4
C.Na2CO3
D.KCl
E. CaCl2
$$$D
Мына тұз гидролизге ұшырағанда, реакция ортасы қышқыл болады:
А.Na2CO3
B. NaCl
C.Na2SO4
D. NH4Cl
E. K2SO4
$$$C
Егер құмырсқа қышқылының КД= 1,8*10-4 болса,
концентрациясы 0,1 моль/л () диссоциация дәрежесі қанша?
А. 6,0%
В. 3%
С. 4,2%
D.2,6%
Е.5,3%
$$$B
Егер ерітіндінің рН = 10 болса, гидроксид-ионының концентрациясы:
А.10-2
В. 10-4
С.10-10
D.рОН=4
Е.10-6
$$$C
Егер рОН = 4 болса, сутегі ионының концентрациясы:
А.4
В.10
С.10-10
D.10-4
Е.5
$$$C
Бренстед теориясы бойынша негіз деп төмендегіні атайды:
A. протон доноры
B. сутек атомының доноры
C. акцептор
D. гидроксил акцепторы
Е. протон доноры, гидроксил акцепторы
$$$A
Калий карбонатының реакция ортасы:
А. сілтілік
В. қышқылдық
С. газдық
D. нейтрал
Е. сұйық
$$$C
300 г, 5 %-ті ерітіндідегі зат массасы:
A. 5 г.
B. 10 г.
C. 15 г.
D. 20 г.
E. 30 г.
$$$B
1литрінде 6,3 г. азот қышқылы бар ерпітіндінің молярлы концентрациясы :
A. 0,5
B. 0,1
C. 0,3
D. 0,2
E. 0,01
$$$C
500 мл, 0,01н. күкірт қышқылының ерітіндісін даярлау үшін қажет массасы:
A. 0,546 г.
B. 0,214 г.
C. 0,245 г.
D. 0,235 г.
E. 0,045 г.
$$$C
Ерітінді бетіндегі еріткіштің қаныққан буының салыстырмалы төмендеуі қандай шамаға тең:
A. ерітіндінің молярлы концентрациясына
B. нормальді концентрациясына
C. мольдік есесіне
D. процентті концентрациясына
E. титріне
$$$D
Келтірілген дисперсті жүйелердің қайсысын ерітіндіге жатқызуға болады:
A. аэрозоль
B. түтін
C. тұман
D. таза ауа
E. шаңды ауа
$$$C
Мына заттардың қайсысы электролит:
A. С10Н8
B. С6Н12О6
C. НСІ
D. С3Н8О3
Е. С12Н22О11
$$$E
0,1 М СаСІ2 ерітіндісінің иондық күші :
A. 0,6
B. 0,5
C. 0,4
D. 0,2
E. 0,3
$$$D
Электролиттік диссоциация дегеніміз электролит молекуласының, қай фактор әсерінен иондарға ыдырау процессі:
A. электр тоғының
B. иондар энергиясының
C. қыздырудың
D. еріткіштің полюсті молекулаларының
E. сұйылту
$$$B
Әлсіз электролиттер диссоциациясының константасы қай факторға тәуелсіз:
A. температураға
B. концентрацияға
C. еріткіш табиғатына
D. еріген зат табиғатына
E. еріген зат және еріткіш табиғатына
$$$C
Қай зат күшті электролит:
A. НҒ
B. Н3РО4
C. НСІ
D. Н2СО3
E. НNO3
$$$A
Қай зат әлсіз электролит:
A. НNO2
B. НNO3
C. NaOH
D. CaCl2
E. HCl
$$$C
Мына реакцияның Ғе(ОН)3+НСІ =Ғе(ОН)2СІ + Н2О қысқартылған иондық теңдеуін көрсет:
A. Ғе+3+3(ОН)- + Н+ = Ғе(ОН)2+ + Н2О
B. Ғе+3+2(ОН)- = Ғе(ОН)2+
C. Ғе(ОН)3 + Н+ = Ғе(ОН)2+ + Н2О
D. Н++ОН-= Н2О
E. Ғе(ОН)3 + Н+ = Ғе(ОН)2+
$$$D
Концентрация [Н+]= 10-5моль/л тең. рОН мәнін тап:
A. 5
B. 8
C. 10
D. 9
E. 14
$$$B
Ерітінді рН-ы 8-ге тең. Гидроксид- иондарының концентрациясын анықта:
A. 6
B. 10-6
C. 8
D. 10-8
E. 10-14
$$$A
Қай зат еғрітіндісі нейтрал ортаны көрсетеді:
A. NaCl
B. NaOH
C. NH4OH
D. CH3COOH
E. HCl
$$$E
Қай зат сатылы гидролизге түседі:
A. СН3СООН
B. NH4NO3
C. KNO2
D. CH3COONH4
E. AlCl3
$$$E
Қай тұз гидролизге түспейді:
A. NH4NO3
B. AlCl3
C. Na2CO3
D. BaCl2
E. KCl
$$$E
Ерітіндісінің рН-шы 7 тең болатын тұзды көрсет:
A. К3РО4
B. АІСІ3
C. ZnCl2
D. K2CO3
E. NaCl
$$$B
Қайтымсыз гидролизге түсетін тұзды көрсет:
A. К2СО3
B. Ғе2(СО3)3
C. NH4Cl
D. NaCN
E. NH4NO3
$$$C
Cілтілік ортаны түзе жүретін тұзды көрсет:
A. NH4Cl
B. KCl
C. K2CO3
D. NaNO3
E. Ca(NO3)2
$$$C
Нейтрал ортадағы сутегі иондарының концентрациясы:
A. 710-7
B. 14
C. 10-7
D. 7
E. 10-1
$$$A
Тек А1С13 тұзының гидролизі кезінде түзілетін иондар:
A. А1ОН+2,Н+,С1-
B. А1(ОН)2+,А1+3,С1-
C. А1+3,ОН-, С1-
D. А1(ОН)3,Н+,С1-
E. А1+3,Н+,С1-
$$$D
Неғұрлым жоғары дәрежеде гидролизденетін қосылысты көрсет:
A. К2СО3
B. NH4Cl
C. NaNO2
D. Al2S3
Li2SO3
$$$А
HNO2 диссоциациясы константасының дұрыс теңдеуі :
A.
B.
C.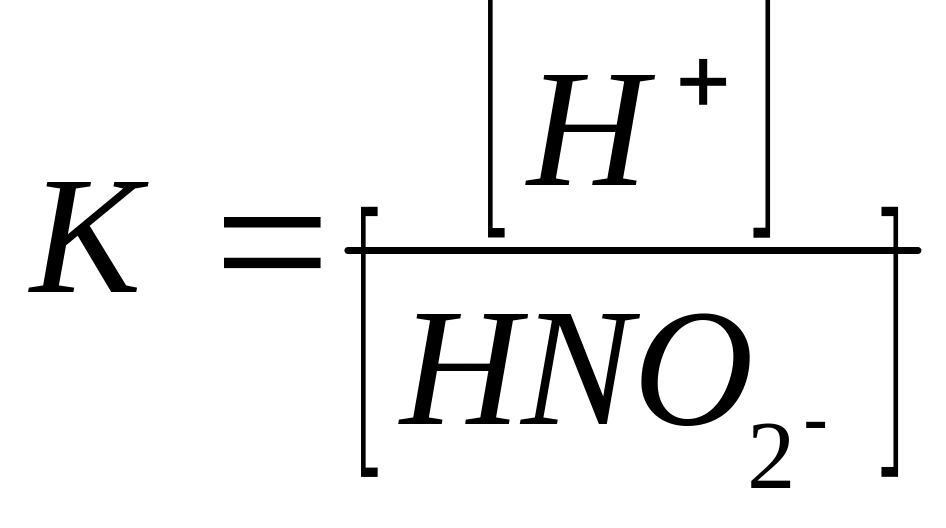
D.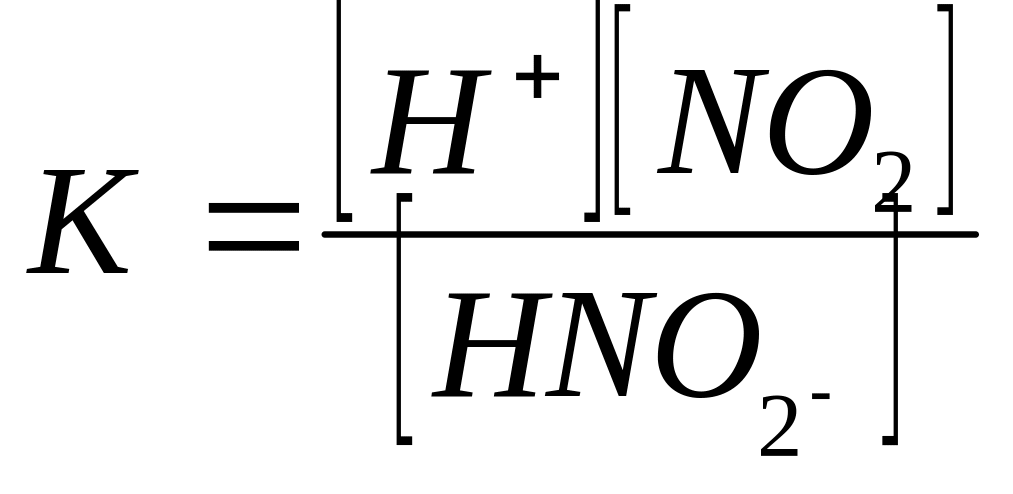
Е.
$$$B
2л 0,1н Н3РО4 ерітіндісінде қанша фосфор қышқылы бар:
3,26г
6,54г
32,6г
65,0г
Е. 16,3г
$$$C
Осмостық қысым қандай факторларға тәуелді:
A. ерітінді концентрациясына
B. температураға
C. ерітінді концентрациясына, температураға
D. еріген зат табиғатына
Е. ерітінді концентрациясына, еріген зат табиғатына
$$$D
Концентрациясы 0,01 моль/л болатын натрий хлориді ерітіндісінің иондық күші төмендегіге тең:
0,02
0,05
C. 0,04
D. 0,01
Е. 0,005
$$$C
Диссоциация константасының мәні бойынша ең әлсіз электролитті көрсет:
A. КHF=6,6*10-4
B. КCH3COOH=1,8*10-5
C. КHCN=7,9*10-10
D. КHCOOH=1,8*10-4
Е. КHNO2= 4*10-4
$$$E
Сутек иондарының концентрациясы 10-4 моль/л. Ерітіндінің рН-ын анықта:
6
8
10
2
Е. 4
$$$A
