
- •1. Робоче тіло – ідеальний газ
- •1.1.1. Маса ідеального газу
- •1.1.2. Визначимо параметри стану в початковій точці циклу
- •1.1.3. Визначимо параметри стану в точці 5
- •1.1.4. Обчислення параметрів стану в точці 4
- •1.1.5. Визначення параметрів стану в точці 3
- •1.1.6. Встановлення параметрів стану в точці 2
- •1.1.7. Зображення циклу ідеального газу рv - і Тs - діаграмах
- •1.2. Розрахунок процесів, що входять до циклу
- •1.2.1. Процес 1-2
- •1.2.2. Процес 2-3
- •1.2.3. Процес 3-4
- •1.2.4. Процес 4-5
- •1.2.5. Процес 5-1
- •1.3. Розрахунок циклу за іі законом термодинаміки
- •2. Робоче тіло – реальний газ (н2о)
- •2.1.1. Параметри стану водяної пари у початковій точці 1
- •2.1.2. Параметри водяної пари в точці 5
- •2.1.3. Параметри водяної пари в точці 4
- •2.1.4. Параметри водяної пари в точці 3
- •2.1.5. Параметри водяної пари в точці 2
- •2.2. Розрахунок процесів водяної пари
- •2.2.1. Процес 1-2
- •2.2.2. Процес 2-3
- •2.2.3. Процес 3-4
- •2.2.4. Процес 4-5
- •2.2.5. Процес 5-1
- •2.3. Аналіз циклу водяної пари за іі законом термодинаміки
- •2.4. Ексергетична оцінка теплообмінного пристрою
2.1.4. Параметри водяної пари в точці 3
За умовою задачі процес 3-4 ізобарний і питомий об’єм у точці 3 в 6 разів менший від питомого об’єму в точці 1. Розрахуємо v3:
v3=v1/b=0,28/2=0,14 м3/кг
Точка 3 знаходиться на перетині ізобари p4 = 24 бар та ізохори v3= 0,14 м3/кг

Графічно визначаємо t3=466,9ºC, h3=3390,1 кДж/кг, s3=7,25 кДж/(кг·К).
Внутрішня енергія: u3 = h3 – p3v3=3390,1- 24·10 ∙0,14 = 3056,1 кДж/кг.
Параметри точки 3 запишемо в таблицю 3.
2.1.5. Параметри водяної пари в точці 2
Т очка
2 є останньою точкою, яку треба знайти,
будуючи цикл у hs-діаграмі. Вона одночасно
належить до адіабатного процесу стиснення
2-3 та ізотермічного процесу відведення
теплоти 1-2. Цю точку визначимо на перетині
ізотерми, що проходить через точку 1 та
адіабати, яка проходить через точку 3.
Побудований цикл зображено на рисунку:
очка
2 є останньою точкою, яку треба знайти,
будуючи цикл у hs-діаграмі. Вона одночасно
належить до адіабатного процесу стиснення
2-3 та ізотермічного процесу відведення
теплоти 1-2. Цю точку визначимо на перетині
ізотерми, що проходить через точку 1 та
адіабати, яка проходить через точку 3.
Побудований цикл зображено на рисунку:
t2= t1=400ºC, s1= s3=7,25 кДж/(кг·К).
Параметри стану h2=3255,2 кДж/кг, v2=0,19 м3/кг, р2=1,57 бар – знаходимо з діаграми.
Внутрішню енергію розрахуємо:
u2 = h2 – p2v2=3255,2 – 1,57 ∙10 ∙0,19 = 3224,8 кДж/кг/
Остаточно заповнимо таблицю параметрів водяної пари.
h s-діаграма
циклу
s-діаграма
циклу
2.2. Розрахунок процесів водяної пари
Усі процеси, що складають цикл, зображені при визначенні параметрів останньої точки циклу. Розрахунок кожного процесу будемо вести у такій послідовності. По-перше, знайдемо ∆U, ∆H, ∆S у процесі; по-друге, розрахуємо Q, L, Lн; по-третє, складемо енергетичний баланс процесу за І законом термодинаміки, покажемо схему енергобалансу; по-четверте, накреслимо процес у hs-, Ts-, i pv- діаграмах водяної пари.
Таблиця 4
Процеси |
∆Uі, кДж |
∆Hі, кДж |
∆Sі, кДж/K |
Qі, кДж |
Lі, кДж |
Lні, кДж |
1-2 |
539,52 |
-15,27 |
-0,35 |
-234,52 |
-774,05 |
-219,25 |
2-3 |
-339,34 |
271,46 |
0 |
0 |
339,34 |
271,46 |
3-4 |
1143,7 |
1447,77 |
1,62 |
1447,77 |
304 |
0 |
4-5 |
-303,9 |
-380,61 |
0 |
0 |
303,9 |
380,61 |
5-1 |
-1039,98 |
-1323,34 |
-1,27 |
-1039,98 |
0 |
283,36 |
∑ |
0 |
0 |
0 |
173,27 |
173,27 |
173,27 |
2.2.1. Процес 1-2
По аналогії з ідеальним газом першим йде процес 1-2 – процес ізотермічного розширення. Для цього ізотермічного процесу простежується різниця властивостей ідеального газу та водяної пари. У процесі 1-2 ідеального газу внутрішня енергія і ентальпія рівна нулю. Для водяної пари U=ƒ(T,p) і H=φ(T,p), тобто ∆U та ∆H не будуть мати нульового значення:
∆U1-2 = m·(u2 – u1) = 2,01·(3234,8-2956,6) = 539,52 кДж
∆H1-2 = m·(h2 – h1) = 2,01·(3255,2-3262,8) = -15,27 кДж
Зміна ентропії в процесі 1-2 менша нуля
∆S1-2= m·(s2 – s1) = 0.271·(7,25-7,42) = -0,35 кДж/К
За
формулою
![]() розрахуємо
кількість теплоти, що відводиться у
процесі
розрахуємо
кількість теплоти, що відводиться у
процесі
Q1-2=mT1(s2-s1)= 0.271·673·(7,25-7,42) =-234,52kДж
Згідно І закону термодинаміки
Q = ∆U + L → L1-2=Q - ∆U1-2= -774,05 кДж
Q = ∆H + Lн → Lн1-2=Q - ∆Н1-2=-219,25 кДж
 На
основі останніх рівнянь складемо схему
енергобалансу.
На
основі останніх рівнянь складемо схему
енергобалансу.
Зобразимо
процес 1-2 у hs-,
Ts-,
i pv-
координатах
p1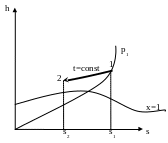

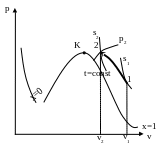
Занесемо отримані дані в таблицю 4.
