
- •1. Робоче тіло – ідеальний газ
- •1.1.1. Маса ідеального газу
- •1.1.2. Визначимо параметри стану в початковій точці циклу
- •1.1.3. Визначимо параметри стану в точці 5
- •1.1.4. Обчислення параметрів стану в точці 4
- •1.1.5. Визначення параметрів стану в точці 3
- •1.1.6. Встановлення параметрів стану в точці 2
- •1.1.7. Зображення циклу ідеального газу рv - і Тs - діаграмах
- •1.2. Розрахунок процесів, що входять до циклу
- •1.2.1. Процес 1-2
- •1.2.2. Процес 2-3
- •1.2.3. Процес 3-4
- •1.2.4. Процес 4-5
- •1.2.5. Процес 5-1
- •1.3. Розрахунок циклу за іі законом термодинаміки
- •2. Робоче тіло – реальний газ (н2о)
- •2.1.1. Параметри стану водяної пари у початковій точці 1
- •2.1.2. Параметри водяної пари в точці 5
- •2.1.3. Параметри водяної пари в точці 4
- •2.1.4. Параметри водяної пари в точці 3
- •2.1.5. Параметри водяної пари в точці 2
- •2.2. Розрахунок процесів водяної пари
- •2.2.1. Процес 1-2
- •2.2.2. Процес 2-3
- •2.2.3. Процес 3-4
- •2.2.4. Процес 4-5
- •2.2.5. Процес 5-1
- •2.3. Аналіз циклу водяної пари за іі законом термодинаміки
- •2.4. Ексергетична оцінка теплообмінного пристрою

Варіант 1-12
Робоче завдання:
|
1 |
2 |
3 |
4 |
5 |
V, м3 |
C |
|
|
|
|
P, бар |
D |
|
|
G |
|
T, K |
E |
|
|
|
F |
Співвідношення |
b= v1/v3 |
||||
ГАЗ |
Ідеальний |
a |
|||
ГАЗ |
Реальний |
H2O |
|||
Вихідні дані:
a |
b |
c |
d |
e |
f |
g |
H,кДж/K |
i |
Газ |
v1/v3 |
V1, м3 |
P1 ,бар |
Т1 ,K |
Т5 ,К |
P4 ,бар |
ΔSr |
% |
O2 |
2,0 |
0,56 |
11 |
673 |
973 |
24 |
0,8 |
5,0 |
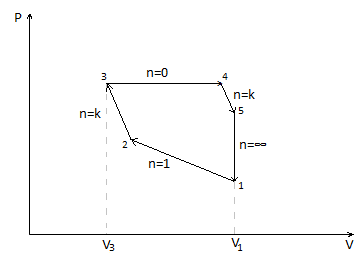
1. Робоче тіло – ідеальний газ
1.1.1. Маса ідеального газу
Визначимо масу робочого тіла (O2), яке виконує цикл, використовуючи рівняння стану ідеального газу pV=mRT. Питому газову сталу, що входить у цю формулу, розраховуємо за співвідношенням: R=µR/µ, в якому універсальна газова стала µR=8314 Дж/(кмоль·К), а молярна маса O2:
µ = 32 г/моль
R= µR/µ=8314/32=259,81 Дж/(кг·К)
m= P1·V1/RT1=(11·105·0,56)/( 259,81 ·673)=3,52 кг.
1.1.2. Визначимо параметри стану в початковій точці циклу
Розрахуємо невідомі параметри стану у вузлових точках циклу. За вихідну точку візьмемо точку 1, тому що для неї відомі два параметри стану: P1 =1,1 МПа, та Т1 = 673 К. Питомий об’єм O2 можна знайти, якщо поділити об’єм ідеального газу в точці 1 на масу робочого тіла:
v1 =V1/m=0,56/3,52=0,16 м3/кг.
Питому внутрішню енергію, питому ентальпію та питому ентропію обчислимо за залежностями:
u=cv·Tі
s=cp·ln(Tі/Тн.у.) - R·ln(Pі/Pн.у.)
h=cp·Tі ,
якщо спочатку знайдемо ізобарну та ізохорні масові теплоємності O2 . Молярні теплоємності µcp та µcv отримаємо в залежності від атомності газу:
Газ |
Молярна теплоємність |
k = µcp/µcv |
|
µcp, кДж/(кмоль К) |
µcv, кДж/(кмоль К) |
||
Одноатомний |
12,6 |
20,9 |
1,66 |
Двохатомний |
20,9 |
29,2 |
1,4 |
Трьох- і багато-атомний |
29,2 |
37,2 |
1,29 |
µcp=29.2 кДж/(кмоль К)
µcv=20.9 кДж/(кмоль К)
cр =µcp/µ=29.2/32=0,91 кДж/(кг К)
cV = µcv/µ=20.9/32=0,65 кДж/(кг К)
k = µcp/µcv = 1.4
Зробивши розрахунки отримаємо:
u1=cv·T1 = 0,65·673= 439,55 кДж/кг
h1=cp·T1 = 0,91 ·673 = 614,11 (кДж/кг)
s1=cp·ln(![]() )
- R·ln(
)
- R·ln(![]() )=
0,91·ln(
)=
0,91·ln(![]() )–0,25981·ln(
)–0,25981·ln(![]() )=0,2
кДж/(кг ·К)
)=0,2
кДж/(кг ·К)
Перевіримо одержані результати за рівнянням стану:
R·Т1=p1·v1
або R
=![]() =
=![]() =259,81
Дж/(кг ·К)
=259,81
Дж/(кг ·К)
В попередніх розрахунках ми знайшли
R = 259,81 Дж/(кг ·К) Δ1 =0%
Виконаємо розрахунок ексергії. Знайдемо ентальпію та ентропію O2 при параметрах навколишнього середовища:
Т0=300 К і p0=1.013 бар = 760 мм.рт.ст.
h0=cp·T0 = 0,91·300 = 273,75 кДж/кг;
s0=cp·ln(![]() )
- R·ln(
)
- R·ln(![]() )=0,91·ln(
)=0,91·ln(![]() )=
0,094 кДж/(кг ·К)
)=
0,094 кДж/(кг ·К)
Розрахуємо ексергію за формулою:
e1 = (h1-h0) – T0·(s1-s0) = (614,11 – 273,75) - 300·(0,2 - 0,094) = 305,08 кДж/кг
Результати обчислень для точки 1 зведемо в таблицю 1:
Параметри |
Точки |
||||
1 |
2 |
3 |
4 |
5 |
|
pi, MПа |
1100000,00 |
1769910,39 |
2400000,00 |
2400000,00 |
1590341,75 |
Ti, K |
673,00 |
673,00 |
734,18 |
1094,40 |
973,00 |
vi, м3/кг |
0,16 |
0,10 |
0,08 |
0,12 |
0,16 |
Перевірка R |
259,81 |
259,81 |
259,81 |
259,81 |
259,81 |
ui, кДж/кг |
439,55 |
439,55 |
479,51 |
714,78 |
635,49 |
hi, кДж/кг |
614,11 |
614,11 |
669,94 |
998,64 |
887,86 |
si, кДж/(кг·К) |
0,20 |
0,08 |
0,08 |
0,44 |
0,44 |
ei, кДж/кг |
305,08 |
342,15 |
397,89 |
617,31 |
506,65 |
Точка 1 відноситься до двох процесів: до процесу ізотермічного стиснення 1-2 та до процесу ізохорного пониження тиску 5-1. У першому випадку точка 1 є початковою, а у другому – кінцевою точкою процесу. Аналізуючи умову завдання, приходимо до висновку, що при наступних обчисленнях будемо розглядати процес 5-1 ,оскільки для точки 2 є невідомими жодного параметра стану.
