
- •Молекулярная и простейшая формула вещества.
- •Абсолютная плотность газа при нормальных условиях.
- •Часть 1. Определение формулы вещества по составу.
- •Часть 2. Определение формулы вещества по продуктам сгорания.
- •Часть 3. Определение формулы вещества по химическим свойствам.
- •III. Усвоение новых знаний
- •I. Вывод формул веществ по массовым долям элементов.
- •II. Вывод формул веществ по массовым долям элементов и данным для нахождения истинной молярной массы (плотности, массе и объёму газа или относительной плотности).
- •III. Вывод формул веществ по продуктам сгорания.
- •IV. Вывод формул органических веществ по общим формулам.
- •1. Вывод формул по известной массовой доле элемента в веществе.
- •2. Вывод формул по известным данным для нахождения истинной молярной массы (плотности, относительной плотности, массе и объёму).
- •3. Вывод формул по уравнениям реакций в общем виде, если известны данные для двух веществ.
- •«Решение задач на нахождение молекулярной формулы органического соединения».
- •II способ. Расчет по уравнению реакции
- •«Решение задач на нахождение молекулярной формулы органического соединения».
- •6. Рефлексия.
- •«Решение задач на нахождение молекулярной формулы газообразного углеводорода по его плотности и массовой доле элементов» Вывод формул соединений.
- •Алгоритм 1. Решение расчетных задач на вывод молекулярной формулы вещества по массовым долям элементов
- •Алгоритм 2. Решение расчетных задач на вывод молекулярной формулы вещества по массе (объему) продуктов сгорания
- •1 Л газа – 1,875 г,
- •26 Г углеводорода (CxHy) составляет 100 %
- •26 Г углеводорода (CxHy) составляет 100 %
- •11 Класс.
11 Класс.
Напишите уравнения реакций, при помощи которых можно осуществить следующие превращения:
Этанол
 бутадиен
-1,3
бутадиен
-1,3
В склянках без этикеток находятся следующие вещества: сухие хлорид алюминия, карбонат натрия, преманганат калия; порошки алюминия и магния, а также растворы соляной кислоты и гидроксида натрия. В вашем распоряжении имеются вода, горелка и любое количество пробирок. Определите, к какой склянке находится каждое из веществ. Опишите порядок проведения опытов, уравнения реакций и признаки, по которым вы отличили вещества.
На смесь сульфида цинка, хлорида натрия и карбоната кальция массой 80г. подействовали избытком соляной кислоты. При этом образовалась смесь газов объемом 13,44л. (у.н.). При взаимодействии этой газовой смеси с избытком оксида серы (IV) образовалось твердое вещество массой 19,2г. Определите массовые доли веществ в этой смеси.
Определите массу осадка, который образуется при смешении раствора с массовой долей хлорида бария 5% и раствора с массовой долей сульфата натрия 8%. Масса раствора
 равна 15 г,
равна 15 г,  - 10г.
- 10г.Имеется смесь фенола с этанолом. К одной половине смеси добавили избыток металлического натрия, получив водород объемом 672 мл (н.у.). К другой половине смеси добавили избыток раствора брома, при этом образовалось осадок массой 6,62г. Определите массовые доли фенола и этанола в смеси.

 т.к. вещество х - продукт, реагирующий
HBr
т.к. вещество х - продукт, реагирующий
HBr
 бромэтан
бромэтан


По внешнему виду 4 группы: две жидкости (HCl и NaOH), металлы (Zn и Mg)
Белые
кристаллические вещества  и
и  окрашенные кристаллы
окрашенные кристаллы 
Р-р HCl можно отличить от р-ра NaOH действием по изменению окраски р-ра и выделению газа с характерным запахом

 пр. восстановления
пр. восстановления
 пр. окисления
пр. окисления
Для дополнительного доказательства наличия HCl и различия кристаллов и





Для различия металлов их растворяют в HCl




Только
 растворяется в NaOH.
растворяется в NaOH.

 (a)
(a)
 (б)
(б)
Смесь
газов:  и
и  объемом V.
объемом V.
С оксидом серы (IV) реагирует образуя твердое вещество S:
 (в)
(в)
Определяем количество полученной серы:

На основании уравнений реакций (в) записываем:

При н.у. этот газ занимает объем:

Объем оксида углерода(IV) в газовой смеси

Количества
вещества 
Из уравнения (а) :


Из уравнения (б) :


Масса
NaCl:

m(NaCl)= 80-38,8-20=21,2
Массовые доли:

 (25%)
(25%)

Определяем
массу и количество вещества растворенного



Определяем
массу и количество  в растворе:
в растворе:

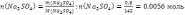
Из
уравнения следует, что для реакции с
0,0056 моль  требуется 0,0056 моль
требуется 0,0056 моль  , следовательно, сульфат натрия взят в
избытке
, следовательно, сульфат натрия взят в
избытке
Из уравнения реакции

Масса выпавшего осадка

Обозначим m-масса половины смеси (для каждого опыта)
В
реакции с  вступает только фенол:
вступает только фенол:
а)

Количества вещества:

Из
уравнения (а): 
Масса фенола в смеси массой m составляет:

В другой пробе массой m фенол реагирует с натрием
б)

Из
уравнения (б) 
в)

общее
количество  , образовавшегося в (б) и (в)
, образовавшегося в (б) и (в)

Количество
вещества  , полученного по реакции (в)
, полученного по реакции (в)

Из
уравнения реакции (в) 
Масса этанола в смеси массой m

Масса
образца смеси 
Массовые доли компонентов:


Для подготовки к ЕГЭ

