
- •Классификация хим-х р-й, лежащих в основе промышленных хт процессов
- •Основные характеристики веществ.
- •Критерии эффективности хтп и безразмерные характеристики материального баланса
- •Параллельные и последовательные реакции.
- •Расчет тепловых эф-тов х р
- •Расчет по Фросту
- •Зависимость ∆н от т
- •Зависимость конст равновесия от т
- •Жидкофазные обратимые реакции
- •Экспер-е опред-е равновесного состава реакционной массы и константы равновесия
- •Расчет равновесного состава по к
- •Законы смещения равновесия
- •Зависимость скорости химических реакций от концентрации исходных веществ. Основной закон кинетики
- •Исследование кинетики гомогенных химических процессов
- •Изотермические реакторы периодического действия с постоянным объемом
- •Дифференц метод анализа кинетич кривых
- •Изотермические реакторы идеального смешения периодического действия
- •Дифференциальный метод анализа
- •Особенности исслед-я кинетики гомогенных кат-ких процессов
Классификация хим-х р-й, лежащих в основе промышленных хт процессов
Гомо- и гетерофаз проц. Гомофаз наз процессы, все комп которых находятся в пределах одной фазы: газовой (газофазные процессы) или жидкой (жидкофазные процессы). Гетерофаз проц – это проц, комп кот находятся в двух или более фазах (системы газ – жидкость, газ – твердое тело, две несмешивающиеся жидкости).
Гомо- и гетероген проц. Гомо- и гетероген проц различ по зоне протекания самой х.р.: гомоген проц осущ в объеме какой-либо фазы, гетероген – на поверх-ти раздела фаз.
Понятия фазового сост-я компонентов р-и и зоны ее протекания совсем неоднозначны. Так, сущ гомофазн гетероген проц (н-р, газофазн р-я на тв кат-ре), гетерофазн гомогенные р-и (н-р, сульфир-е бензола, когда реагенты находятся в 2х несмеш-хся фазах, а их вз-е идет в объеме одной из фаз).
Простые
и сложные реакции.Простыми
–р-и, в
кот не образуются измеримые или
существенные для материального
баланса количества других веществ,
кроме тех, что фигурируют
в стехиометрическом уравнении
![]() .Простые
реакции м/б необратимыми и обратимыми.
Сложные р-и состоят из двух или более
макростадий, они дают ряд макропродуктов
и представляют собой совокупность
простых реакций:
.Простые
реакции м/б необратимыми и обратимыми.
Сложные р-и состоят из двух или более
макростадий, они дают ряд макропродуктов
и представляют собой совокупность
простых реакций:
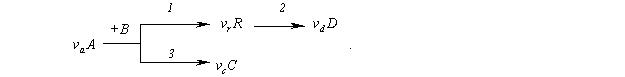
Опись каждой буквы.
Элементар и неэлементар р-и .Элементар р. протек при непосредственном взаим исх в-в, то есть при этом вообще отсутствуют (или их пока не удалось обнаружить) какие-либо микростадии, через которые идет такая реакция
![]()
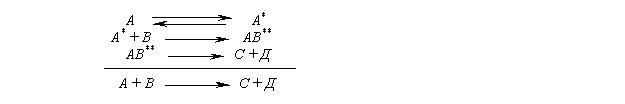 Неэлем
р. имеют ряд химических микростадий,
в
кот участвуют промежут-е комплексы или
частицы, не
фигурирующие в стехиом ур-и.
Неэлем
р. имеют ряд химических микростадий,
в
кот участвуют промежут-е комплексы или
частицы, не
фигурирующие в стехиом ур-и.
Каждая из промежуточных стадий, составл-их неэлем р, является элем. При этом совокупность элементарных р-й, способов образования, природы и дальнейшего взаимодействия промежуточных комплексов и частиц составляет механизм реакции.
Основные характеристики веществ.
1.Концентрация. Вх.т. при опис х.п. исп аналит конц (моль/л) Ci=ni/Vi. Конц выраж этим ур-ем не равна его действ-м конц т.к. реагенты в промеж стадии могут находиться в различ форме. Для непрерыв проц аналит конц: Ci=Yn/Yv. В кач-ве конц исп мольную долю Ni=ni/Σni. Конц выраж кол-м в-ва растворен в опред весовом к-ве или объем р-ра или р-ля.
2.Давление и объем. Согласно з-ну Дальтона парц давл iкомп pi=ni/Σn *p=NiP. В ид-х усл взаимосвязь м/у парц.давл и конц опис ур-ем Клапейрона-Менделеева: pV=nRT, p=CRT.Оч часто при опис х.р. исп з-он согласно к-му при пост Т и Р, объем газа есть линейная функц степени превращ V=V0(1+ξxi). В соответствии с з-ом Гейлюссака при р=конст объем газа есть линейная функц темп-ры V=V0(1+£t) p=p0(1+£t). Летучесть-некоторая функц давления подст к-го в ур-е термодин опис ид сист позвол использ для рассчеты ид сист f=p2/pид; f/p=p/pид=γ-коэф летучести. F=γp a=f/f0.
3.Плотность и вязкость. Плотность ид в-ва опред ρ=M/V. Плотность смеси ρсм=ΣρiNi. Различ динамич вязкость и кинематич. Динамич (н*с/м2) опред только экспер-но с исп вискозиметра. Кинематич-отношение динамич вязк к плотности. Относит вязкость-отношение коэф вязкости в-ва к коэф вязкости жидкости.
4.Теплоемкость.Под теплоем поним то к-во тепла кот нужно подвести чтобы повысить тем-ру ед к-ва в-ва на 1 градус.Истиная теплоемкость-теплоем данного в-ва при данн тем-ре С=dQ/dT.Средняя-в интервале темп-р есть велич пост c=q/∆T.Изохорный: ист Cv=(dU/dT)v; средн Cv=∆U/∆T. Изобарный тоже самое только вместо U –H и v-p.
