
- •Термодинамико-топологический анализ фазовых диаграмм как основа синтеза схем разделения Учебное пособие для самостоятельной работы студентов
- •8. Выявление условий работоспособности простейшего комплекса 77
- •1. Подсистемы химико-технологической системы. Классификация свойств. Диаграммы состав - свойство
- •2. Термодинамические закономерности и моделирование фазовых равновесий
- •2.1. Термодинамические основы фазовых равновесий в многокомпонентных неидеальных системах
- •2.2. Математическое моделирование фазовых равновесий
- •3. Локальные закономерности структур фазовых диаграмм
- •3.1. Процессы, протекающие в поле градиента скалярного свойства
- •3.2. Процесс равновесного открытого испарения
- •4. Нелокальные закономерности диаграмм фазового равновесия (на примере систем "жидкость-пар")
- •5. Классификация диаграмм и их преобразования при варьировании давления (температуры)
- •5.1. Классификация диаграмм трех- и четырехкомпонентных систем
- •5.2. Тангенциальная азеотропия и биазеотропия
- •6. Уравнение процесса ректификации, его анализ. Синтез принципиальных схем ректификации
- •6.1. Уравнение ректификации. Векторные поля рабочих нод и движущей силы процесса
- •6.2. Общие подходы к синтезу технологических схем разделения.
- •6.3. Методы разделения и принципы их выбора
- •7. Принцип перераспределения полей концентраций между областями разделения и приемы его реализации
- •7.1. Реализация принципа перераспределения полей концентраций в процессах ректификационного разделения жидких смесей за счет варьирования внешних параметров
- •7.2. Реализация принципа перераспределения полей концентраций при разделении смесей с различными особенностями фазового поведения
- •7.3. Реализация принципа перераспределения полей концентраций при сочетании различных процессов
- •7.4. Реализация принципа перераспределения полей концентраций в процессах с разделяющими агентами
- •8. Выявление условий работоспособности простейшего комплекса
- •8.1. Тройные системы
- •8.2. Влияние состава исходной смеси на работоспособность комплексов
- •8.3. Четырехкомпонентные смеси
- •Алгоритм анализа балансовых соотношений в четырехкомпонентной системе:
- •Литература
2. Термодинамические закономерности и моделирование фазовых равновесий
Фазовые равновесия различного типа играют важную роль при выборе методов разделения конкретных смесей. Так, например, ректификация базируется на законах о фазовом равновесии системы жидкость–пар, экстракция – жидкость–жидкость, адсорбция – газ–твердое тело или жидкость–твердое тело, абсорбция – газ–жидкость и т.д.
Для расчета массообменных процессов между отдельными фазами необходимо знать составы равновесных фаз при определенных температурах и давлениях. Наиболее надежно эти данные могут быть получены экспериментальным путем в соответствующих приборах. Так, например, данные по фазовому равновесию жидкость–жидкость, полученные при 20 °С, необходимы, главным образом, для предварительных оценок эффективности метода экстракции по сравнению с другими методами разделения, а также для расчета экстракционных установок, флорентийских сосудов, используемых при гетероазеотропной ректификации. Данные же по фазовому равновесию жидкость - жидкость, полученные при температурах кипения и атмосферном (реже при других) давлении, необходимы для расчета установок ректификации гетероазеотропных и расслаивающихся смесей.
Фазовое равновесие системы жидкость-пар для гомогенных (по жидкости) смесей чаще всего исследуется в изобарных условиях (процесс ректификации протекает при P=const).
Однако необходимо иметь в виду, что в реально отводимое время можно изучить фазовое равновесие только в системах, содержащих не более четырех компонентов. Более того, экспериментально можно получить только дискретные данные, тогда как для расчетов соответствующих процессов необходимо располагать аналитическим выражением, связывающим составы равновесных фаз. В связи с этим возникает задача получения аналитической зависимости состава одной фазы от другой в многокомпонентных системах. Такого рода зависимости моделируются с использованием соответствующих моделей с целью выяснения всех физико-химических ограничений на процесс разделения и для проведения автоматизированного проектирования соответствующих установок. В настоящее время моделирование осуществляется с использованием компьютерной техники и современных программных средств (Chemсad, PRO-II и др.).
Математические модели, отражающие взаимосвязь составов равновесных фаз, могут быть получены на основе физических представлений, удовлетворяющих термодинамике гетерогенных равновесий.
2.1. Термодинамические основы фазовых равновесий в многокомпонентных неидеальных системах
Если система, состоящая из r фаз и n компонентов, равновесна, то термодинамика позволяет установить взаимосвязь между различными ее переменными (температура, давление, состав и др.).
Для исследования общих качественных закономерностей фазового равновесия как бинарных, так и многокомпонентных многофазных систем может быть использовано термодинамическое уравнение фазового обмена, предложенное для бинарных смесей Ван-дер-Ваальсом и обобщенное на многокомпонентные смеси А.В. Сторонкиным.
Уравнение Ван-дер-Ваальса-Сторонкина представляет разность нулевых потенциалов равновесных фаз, выраженную в координатах потенциала Гиббса, и для двухфазной (жидкость-пар) n-компонентной системы в общем виде записывается следующим образом:
![]() (2.1)
(2.1)
Здесь
![]() и
и
![]() —
изменения объема и энтропии при фазовом
дифференциальном переходе бесконечно
малого количества смеси из жидкости в
пар, равные соответственно,
—
изменения объема и энтропии при фазовом
дифференциальном переходе бесконечно
малого количества смеси из жидкости в
пар, равные соответственно,
![]() (2.2)
(2.2)
![]() (2.3)
(2.3)
gki - вторая производная g- потенциала, величина которой в силу устойчивости фазы всегда положительна. Для удобства восприятия жидкая фаза обозначена индексом «ж», паровая – индексом «п», а их составы, соответственно, х и y.
Уравнение
(2.1) отнесено к составу жидкой фазы.
Аналогичное уравнение может быть
записано относительно изменения состава
паровой фазы
![]() .
В координатной форме уравнение (2.1)
связывает полный дифференциал изменения
температуры
.
В координатной форме уравнение (2.1)
связывает полный дифференциал изменения
температуры
![]() и давления
и давления
![]() при изменении состава
при изменении состава
![]() с нодой
с нодой
![]() .
Здесь рассматриваются скалярные величины
,
и скалярное произведение двух векторов
и
.
.
Здесь рассматриваются скалярные величины
,
и скалярное произведение двух векторов
и
.
Отметим, что для однокомпонентных смесей уравнение (2.1) превращается в обобщенное уравнение Клаузиуса; для двухкомпонентных смесей имеем классическое уравнение Ван-дер-Ваальса, на основе которого дается математическая интерпретация законов Коновалова и Вревского. С использованием уравнения (2.1) для случая трехкомпонентных систем было сформулировано правило Шрейнемакерса: при изотермическом испарении давление пара монотонно уменьшается, при изобарическом испарении температура кипения раствора монотонно возрастает.
Рассмотрим поведение трехкомпонентных систем при постоянном давлении. В этом случае температура кипения является функцией состава. При выборе в качестве независимых переменных dx1 и dx2 уравнение (2.1) имеет вид:
![]() (2.4)
(2.4)
Выразим дифференциал температуры как функцию состава жидкой фазы:
![]() (2.5)
(2.5)
и подставим значение dT в уравнение (2.4). В результате упрощения получим:
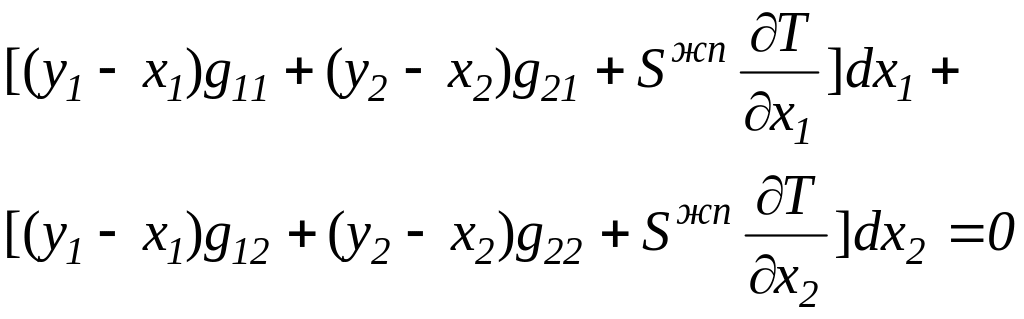 (2.6)
(2.6)
Так как dx1 и dx2 независимые переменные, то уравнение (2.6) будет соблюдаться всегда только в случае, когда каждое из выражений при dx1 и dx2 равно нулю. Следовательно, уравнение (2.6) распадается на два, образующих систему уравнений типа
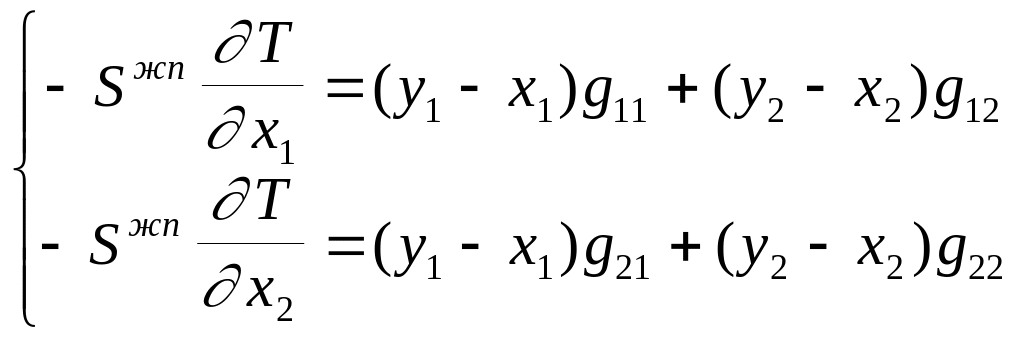 ,
(2.7)
,
(2.7)
которую можно представить в векторной форме:
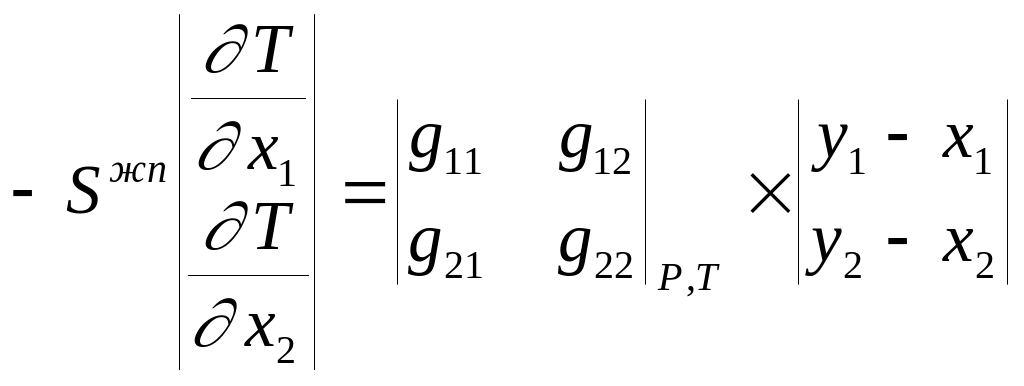 (2.8)
(2.8)
Обобщая приведенный вывод на случай n-компонентной смеси, получим:
при Р=const
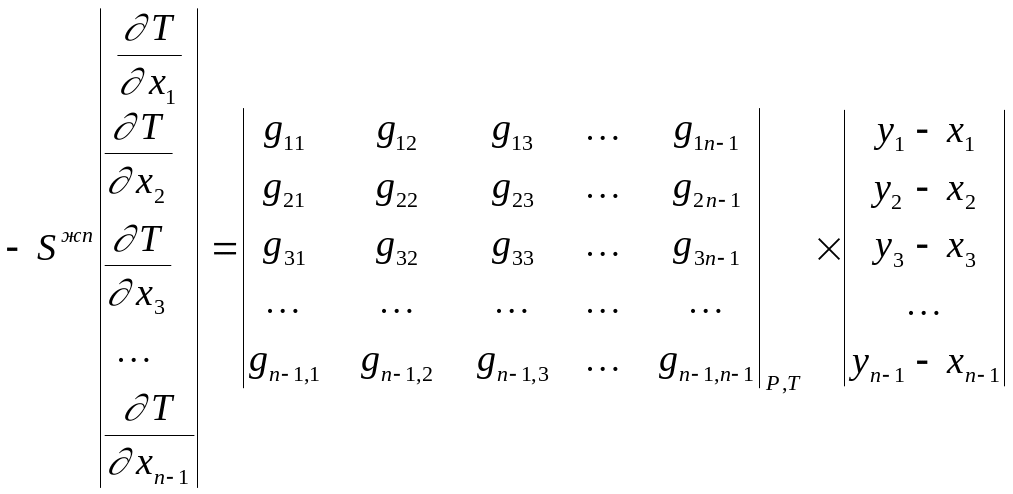 (2.9)
(2.9)
при T=const (вывод аналогичен приведенному выше)
![]()
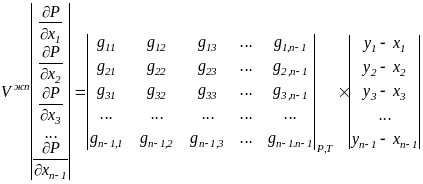 (2.10)
(2.10)
И в сокращенном виде:
![]() (2.11)
(2.11)
![]() (2.12)
(2.12)
Уравнения (2.11) и (2.12) представляют модифицированную форму уравнения (2.1), которая является однозначным отображением векторного поля нод на поле градиента равновесных температур или давлений. Отображение рассматриваемого типа характеризуется переходом от одного поля к другому, топологически ему эквивалентному.
На рис. 2.1. приведено взаимное расположение векторов ноды и градиентов.
Уравнение Ван-дер-Ваальса – Сторонкина содержит всю информацию о гетерогенной системе в равновесных условиях.
При большем числе фаз уравнения типа (2.1) могут быть записаны для любой пары фаз, и фазовое равновесие будет представлено системой дифференциальных уравнений, в которой число независимых уравнений на единицу меньше числа фаз.

Рис. 2.1. Взаимное расположение векторов ноды жидкость-пар и градиента температур и давлений относительно изотермо-изобары
В уравнении Ван-дер-Ваальса – Сторонкина изобарно-изотермический потенциал Гиббса является характеристической функцией и позволяет определить все термодинамические свойства фазы. Частные производные от этого потенциала по числу молей одного из компонентов были названы химическими потенциалами. При переходе к концентрациям имеем, например, следующие выражения для бинарной смеси:
для удельного изобарно-изотермического потенциала фаз
![]() (2.13)
(2.13)
![]() (2.13а)
(2.13а)
Из
(2.13), (2.13а) с учетом
![]() ,
,
![]() ,
следует:
,
следует:
![]() (2.14)
(2.14)
![]() (2.14а)
(2.14а)
Для качественных исследований используется также уравнение для нулевого потенциала, которое имеет вид:
![]() (2.15)
(2.15)
![]() (2.15а)
(2.15а)
Из этого уравнения, в частности, и выводится приведенное ранее уравнение Ван-дер-Ваальса – Сторонкина.
Условия равновесия между двумя фазами могут быть представлены следующим образом:
![]() (2.16)
(2.16)
Следовательно, многофазная многокомпонентная система будет находиться в состоянии равновесия, если температуры, давления и химические потенциалы компонентов во всех фазах равны.
Для равновесного процесса условия (2.16) для смещения равновесия записываются в дифференциальной форме:
![]() (2.16а)
(2.16а)
Уравнение Ван-дер-Ваальса – Сторонкина полезно для качественных исследований поведения гетерогенных систем, а именно: для исследования общих закономерностей фазовых равновесий при различных способах изменения состава одной из фаз, исследования влияния температуры и давления на фазовое равновесие, общих свойств азеотропных смесей и т.д. На основе этого уравнения А.В. Сторонкиным и его учениками была построена общая качественная термодинамическая теория гетерогенных систем.
Что касается количественных закономерностей, то при решении дифференциальных уравнений возникают трудности, связанные с тем, что химические потенциалы не поддаются непосредственному экспериментальному определению. Поэтому на практике пользуются величинами, которые могут быть определены экспериментально и дают возможность оценивать значения химических потенциалов расчетным путем. В частности, такой величиной является фугитивность (летучесть), введенная Г. Льюисом. Обычно оценивают отношение летучести компонентов в реальных и стандартных условиях. В качестве стандартного состояния для реальных газов принимается состояние идеального газа при давлении, равном единице, и температуре, равной температуре реального газа. Для конденсированных фаз за стандартное принимается состояние чистой жидкости при температуре кипения раствора.
Учитывая, что уравнение фазового равновесия предусматривает равенство как химических потенциалов, так и стандартных химических потенциалов, обычно в исследованиях фазового равновесия жидкость–пар за стандартное состояние для обеих фаз принимается состояние чистого компонента при температуре кипения раствора как для жидкой, так и для паровой фаз.
Для описания свойств жидкой фазы, представляющей неидеальный раствор, введены понятия активности (а) и коэффициента активности (), которые определяются следующим образом:
![]() (2.17)
(2.17)
Фазовое поведение идеальной системы жидкость-пар описывается законом Рауля:
![]() (2.18)
(2.18)
где
![]() -
давление насыщенных паров чистого i-го
компонента.
-
давление насыщенных паров чистого i-го
компонента.
Отклонения
от идеальности учитываются введением
соответствующих коэффициентов: активности
![]() для жидкой фазы и летучести
для жидкой фазы и летучести
![]() для паровой фазы.
для паровой фазы.
Фазовое поведение реальной системы жидкость-пар описывается в общем виде уравнением:
![]() (2.19)
(2.19)
В
случае отсутствия ассоциации в паровой
фазе и при относительно небольших
давлениях (1,5х105 Па)
можно считать паровую фазу идеальным
газом. Для идеального газа
![]() .
Неидеальность паровой фазы должна
учитываться при повышенных давлениях
или при наличии ассоциации молекул в
паровой фазе.
.
Неидеальность паровой фазы должна
учитываться при повышенных давлениях
или при наличии ассоциации молекул в
паровой фазе.
Уравнение (2.19) широко используется для расчетов фазовых равновесий, так как при принятых допущениях оно имеет достаточную для инженерных расчетов точность.
Коэффициенты
![]() могут быть рассчитаны через вторые
вириальные коэффициенты. Тогда, при
наличии данных о давлениях паров чистых
компонентов, задача моделирования
фазового равновесия жидкость-пар
сводится к нахождению зависимости
коэффициентов активности отдельных
веществ от состава жидкой фазы.
могут быть рассчитаны через вторые
вириальные коэффициенты. Тогда, при
наличии данных о давлениях паров чистых
компонентов, задача моделирования
фазового равновесия жидкость-пар
сводится к нахождению зависимости
коэффициентов активности отдельных
веществ от состава жидкой фазы.
