
- •Консультация по теме «Строение вещества» Строение многоэлектронных атомов. Квантовые числа
- •Правила и принципы заполнения ао электронами
- •Окислительно-восстановительные свойства атомов
- •Основные виды химической связи:
- •Пространственная структура молекул (обменный механизм образования ковалентной связи)
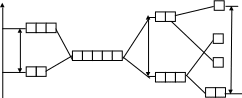
- •1 .1. Простое вещество (н2, f2, Cl2, Br2, i2)
- •1.2. Сложное вещество (hf, hCl, hBr, hi)
- •М олекула со
- •2. Трехатомные молекулы (4а подгруппа – SiCl2, PbBr2… и 6a подгруппа - н2s, н2Se…)
- •Ч етырехатомные молекулы
- •Комплексные соединения (донорно-акцепторный механизм образования ковалентной связи)
- •Взаимодействия между частицами вещества
- •Донорно-акцепторное взаимодействие молекул
- •Водородная межмолекулярная связь
- •Свойства твердых тел
- •Виды кристаллов и их свойства
- •1. Молекулярный.
- •2. Ионный
- •3. Атомно-ковалентный
- •4. Металлический
- •Основные учебники и учебные пособия
Комплексные соединения (донорно-акцепторный механизм образования ковалентной связи)
Комплексные соединения - сложные соединения, содержащие комплекс, между частицами которого осуществляется ковалентная связь по донорно-акцепторному механизму
K[BF4] – тетрафтороборат калия K[BF4] → K + + [BF4]-
K + - внешняя сфера
[BF4]- - внутренняя сфера (комплекс) - в квадратных скобках.
Состав комплекса:
Комплексообразователь (в основном, катион металла) - акцептор
Лиганды (анионы или молекулы) - доноры
Координационное число (к.ч.) – количество лигандов, координируемых комплексообразователем
Между внешней и внутренней сферой – электростатическое ион-ионное взаимодействие
Между комплексообразователем и лигандами – ковалентная связь по донорно-акцепторному механизму: донор – лиганд (поставщик пары электронов), акцептор – комплексообразователь (наличие свободных АО)
Природу связей в КС объясняют методами ВС, МО, теории кристаллического поля.
Все вакантные орбитали комплексообразователя, принимающие участие в образовании связи, одинаковы по энергии и по форме т.е. они гибридизованы.
Тип гибридизации и структура комплексов
К.ч. |
Гибридизация орбиталей |
Структура комплекса |
2 |
sp |
линейная |
4 |
d3s, d2sp, sp3 |
тетраэдр |
4 |
dsp2 |
плоский квадрат |
6 |
d2sp3, sp3d2, dsp3d |
октаэдр |
3 |
sp2 |
плоский треугольник |
5 |
dsp3 |
тригональная бипирамида |
Лиганд сильного поля (электроны на d-подуровне комплексообразователя максимально спариваются)
Лиганд слабого поля (спаривания электронов на d-подуровне комплексообразователя не происходит)
Для 4d-и 5d-элементов – все лиганды сильного поля. Для 3d-элементов - спектрохимический ряд лигандов: I-<Br-<Cl-<ОН-<F-<H2O<NCS-<NH3< NO2-<CN-<CO (в порядке возрастания силы поля) Но границы между сильным и слабым полями лигандов провести сложно.
Под воздействием поля лигандов происходит расщепление d-подуровня (на величину D, называемую энергией расщепления): d-АО с меньшей и d-АО с большей энергией. D - зависит от к.ч., природы лигандов и комплексообразователя (Dрастет с увеличением силы лиганда и к.ч.)
плоский квадрат
 октаэдр
октаэдр
Е тетраэдр
d d
тетр окт пл.квадр.
d
d-орбитали d
свободного иона
комплексообразователя
d-орбитали d-орбитали
в поле лиганда в поле лиганда
Магнитные свойства КС
Парамагнитное вещество – втягивается в магнитное поле. Парамагнетизм обусловлен наличием неспаренных электронов (наличие собственного магнитного момента)
Диамагнитное вещество – выталкивается из магнитного поля (из-за отсутствия неспаренных электронов).
Пример 1
K3[CoF6] – гексафторокобальтат калия
[CoF6]3- - комплекс
Co3+ - комплексообразователь Co3+ …3d64s0
F - - лиганд слабого поля F -…2s22p6
КЧ = 6, т.е. имеет место октаэдрическое расщепление.
Энергетическая диаграмма:
F-: F-: F-: F-: F-: F-:



 Е
Е

3d 4s 4p 4d

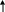



3d
sp3d2 – гибридизация – октаэдр.
внешнеорбитальный, высокоспиновый, парамагнетик
Пример 2
[Co(NH3)6] Cl3 – хлорид гексаамминкобальта
[Co(NH3)6] 3+ - комплекс
Co3+ - комплексообразователь Co3+ …3d64s0
NH3 - лиганд сильного поля (т.к. к.ч.= 6)
КЧ = 6, т.е. имеет место октаэдрическое расщепление
Энергетическая диаграмма
Е :NH3 :NH3 :NH3: NH3:NH3:NH3
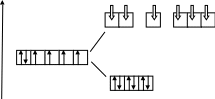
3d 4s 4p
3d 3d
d2sp3-гибридизация– октаэдр;
внутриорбитальный, низкоспиновый (более прочный), диамагнетик.
Пример 3
[Au(NH3)4]Сl3 хлорид тетраамминзолота
[Au(NH3)4]3+ - внутр. сфера ((комплекс)
Сl- - внешняя сфера
Комплексообразователь Au3+:… 5d86s0.
К.ч. = 4, NH3 - лиганд сильного поля , т.к. для 5d- элемента (Au) все лиганды сильного поля, неподеленная пара электронов у атома азота :NH3 , dsp2-гибридизация
Энергетическая диаграмма:

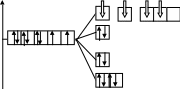 Е
Е
5d
6s 6p
dsp2-гибридизация, структура –
плоский квадрат
низкоспиновый, внутриорбитальный, диамагнетик, устойчивый
