- •Консультация по теме «Строение вещества» Строение многоэлектронных атомов. Квантовые числа
- •Правила и принципы заполнения ао электронами
- •Окислительно-восстановительные свойства атомов
- •Основные виды химической связи:
- •Пространственная структура молекул (обменный механизм образования ковалентной связи)
- •1 .1. Простое вещество (н2, f2, Cl2, Br2, i2)
- •1.2. Сложное вещество (hf, hCl, hBr, hi)
- •М олекула со
- •2. Трехатомные молекулы (4а подгруппа – SiCl2, PbBr2… и 6a подгруппа - н2s, н2Se…)
- •Ч етырехатомные молекулы
- •Комплексные соединения (донорно-акцепторный механизм образования ковалентной связи)
- •Взаимодействия между частицами вещества
- •Донорно-акцепторное взаимодействие молекул
- •Водородная межмолекулярная связь
- •Свойства твердых тел
- •Виды кристаллов и их свойства
- •1. Молекулярный.
- •2. Ионный
- •3. Атомно-ковалентный
- •4. Металлический
- •Основные учебники и учебные пособия
Консультация по теме «Строение вещества» Строение многоэлектронных атомов. Квантовые числа
Квантово-механическая модель атома использует вероятностный подход для характеристики нахождения электрона в определенной области пространства.
Атомная орбиталь (АО) – область пространства, в котором наиболее вероятно нахождение электрона. АО однозначно характеризуется тремя квантовыми числами (КЧ) n, l, ml, а состояние электрона в атоме – четырьмя квантовыми числами: n, l, ml и ms.
Главное квантовое число n - характеризует удаленность электрона от ядра и определяет энергию и размеры атомных орбиталей (АО), принимает значения n = 1,2,3…∞, что соответствует энергетическому уровню. Чем выше значение n, тем выше энергия.
Орбитальное квантовое число l - характеризует форму атомной орбитали, принимает целочисленные значении от 0 до (n-1) и характеризует энергетический подуровень. Разная форма АО определяет разную энергию в пределах одного энергетического уровня (энергетический уровень расщеплен на подуровни). Максимальное число энергетических подуровней на n – уровне равно n (количество подуровней равно номеру уровня).
Магнитное квантовое число ml - характеризует пространственную ориентацию атомной орбитали во внешнем магнитном или электрическом поле, принимает целочисленные значения ml =-l, …, 0, …, +l, на подуровне (2l +1) значений ml и (2l +1) орбиталей. ml - вектор (имеет величину и направление). Все АО одного подуровня в отсутствие внешнего поля имеют одинаковое значение энергии.
Общее число орбиталей на n-ом энергетическом уровне равно n2.
Спиновое квантовое число ms – характеризует величину и ориентацию «спина», ms принимает только два значения: +½ (↑) и -½ (↓). Спин - собственный механический момент количества движения электрона, связанный с его вращением вокруг своей оси (спин – вектор).
-
↑↓
Максимально возможное число электронов на n-ом энергетическом уровне равно 2n2.
На первом уровне (n=1) → один подуровень (1s) 1АО 2 ē
На втором уровне (n=2) → два подуровня (2s, 2p) 4АО 8 ē
На третьем уровне (n=3) → три подуровня (3s, 3p, 3d) 9АО 18 ē
На четвертом уровне (n=4) → четыре подуровня (4s, 4p, 4d, 4f) 16АО 32 ē
Еs<Еp<Еd<Еf для одного уровня
АО: это совокупность положений электрона в атоме с определенными n, l, ml (т.е. энергией, размерами, формой и ориентацией в пространстве), условно АО обозначают □
Одна s орбиталь □ l= 0 ml= 0
(сфера)
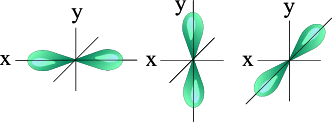
Три p орбитали □□□ l= 1 ml= -1,0,+1
(гантели)
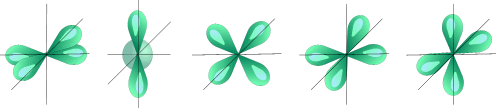
Пять d орбиталей □□□□□ l= 2 ml= -2,-1,0,+1,+2
(4-хлепестковые розы)
Семь f орбиталей □□□□□□□ l= 3 ml= -3,-2,-1,0,+1,+2,+3
(сложная форма)
|
|
S - орбиталь |
Три p – орбитали |
|
Пять d – орбиталей |