
- •С.Г. Козлов, м.А. Куликов основыхимической технологии
- •240301.65 «Химическая технология неорганических веществ»
- •Введение
- •1. Общие понятия о химическом производстве
- •1.1. Химическая технология как наука
- •1.2. Связь химической технологии с другими науками
- •1.3. Развитие химической технологии
- •1.4. Классификация химической технологии
- •2. Компоненты химического производства
- •2.1. Сырье в химическом производстве
- •2.1.1. Основные определения
- •2.1.2. Классификация сырья
- •2.1.3. Ресурсы и рациональное использование сырья
- •2.1.4. Подготовка минерального сырья
- •2.1.5. Очистка и разделение газовых смесей
- •2.2. Энергия в химической технологии
- •2.2.1. Использование энергии в химической технологии
- •2.2.2. Источники энергии. Классификация источников энергии
- •2.2.3. Рациональное использование энергии
- •2.2.4.Новые виды энергии в химической технологии
- •2.3. Вода в химической промышленности
- •2.3.1. Основные показатели качества воды
- •2.3.2. Промышленная водоподготовка
- •2.4. Воздух в химической технологии
- •3. Критерии оценки эффективности химического производства
- •3.1. Технические показатели
- •3.2. Экономические показатели
- •3.3. Эксплуатационные показатели
- •3.4. Социальные показатели
- •3.5. Материальный и энергетический баланс химического производства
- •4. Системный подход в изучении химико-технологического процесса
- •4.1. Общие понятия и определения
- •4.2. Химико-технологическая система как объект моделирования
- •4.3. Операторы
- •4.4. Матричное представление моделей
- •4.5. Подсистемы хтс
- •4.6. Связи
- •4.7. Классификация технологических схем
- •4.8. Системный подход к разработке технологии производства
- •4.8.1. Методологические принципы
- •4.8.2. Выбор технологии производства продукции
- •4.9. Оптимизация производства
- •4.9.1. Декомпозиция химико-технологических систем
- •4.9.2. Оптимизация химико-технологических систем
- •5. Общие закономерности химических процессов
- •5.1. Понятие о химическом процессе
- •5.2. Классификация химических реакций
- •5.3. Виды химических реакций
- •5.4. Характеристика гомогенных процессов
- •5.5. Основные закономерности гомогенных процессов
- •5.6. Интенсификация гомогенных процессов
- •5.7. Гетерогенные некаталитические процессы
- •5.8. Интенсификация процессов, основанных на необратимых реакциях
- •5.9. Интенсификация процессов, основанных на обратимых реакциях
- •6. Гетерогенный катализ
- •6.1. Общие положения катализа
- •6.2. Процессы адсорбции и хемосорбции в гетерогенном катализе
- •6.2.1. Теория адсорбции Лэнгмюра
- •6.2.2. Нелэнгмюровская адсорбция
- •6.3. Механизм гетерогенных каталитических процессов
- •6.3.1. Внешняя диффузия
- •6.3.2. Внутренняя диффузия
- •6.4. Основные требования к гетерогенным катализаторам
- •6.5. Основные структурные параметры гетерогенных катализаторов
- •6.6. Технологические свойства гетерогенных катализаторов
- •6.7. Классификация гетерогенных катализаторов
- •6.8. Состав катализаторов
- •6.9. Приготовление катализаторов
- •7. Гомогенный катализ
- •7.1. Кислотный (основной) катализ
- •7.1.1. Специфический кислотный катализ
- •7.1.2. Специфический основной катализ
- •7.1.3. Общий кислотный катализ
- •7.1.4. Общий основной катализ
- •7.1.5. Электрофильный катализ
- •7.1.6. Кинетика реакций кислотно-основного катализа
- •7.2. Металлокомплексный катализ
- •7.3. Ферментативный катализ
- •8. Химические реакторы
- •8.1. Принципы классификации химических реакторов
- •8.2. Принципы проектирования химических реакторов
- •8.2.1. Моделирование химических реакторов и протекающих в них процессов
- •8.2.2. Структура математической модели химического реактора
- •8.2.3. Уравнение материального баланса для элементарного объема проточного реактора
- •8.3. Химические реакторы с идеальной структурой потока в изотермическом режиме
- •8.3.1. Реактор идеального смешения (рис)
- •8.3.2. Реактор идеального вытеснения (рив)
- •8.3.3. Примеры аналитического решения математической модели
- •8.4. Сравнение эффективности проточных реакторов идеального смешения и идеального вытеснения
- •8.5. Конструкции реакторов
- •8.5.1. Требования к реакторным конструкциям
- •8.5.2. Типизация реакторов
- •8.5.3. Примеры конструкций реакторов
- •9. Переработка природного минерального сырья
- •9.1. Процессы растворения
- •9.2. Процессы кристаллизации
- •9.3. Химическое осаждение
- •9.4. Процессы переработки труднорастворимого сырья
- •10. Химические предприятия верхнекамья
- •10.1. Оао «Уралкалий»
- •10.2. Филиал «Азот» оао «охк уралхим»
- •10.3. Оао «Березниковский содовый завод»
- •10.4. Ооо «Сода-хлорат»
- •10.5. Оао «Метафракс»
- •Рекомендуемая литература
1.2. Связь химической технологии с другими науками
Химическая технология базируется на материале целого ряда наук: инженерных и химических, математике, физике, механике, гидродинамике, минералогии и других.
В то же время сама химическая технология составляет основу экономических наук, изучающих химическую технологию, ее данные используют при изучении экологических проблем, научно-инженерной этики.
Связи химической технологии с другими науками и областями знаний можно представить схемой, изображенной на рисунке 1.1.
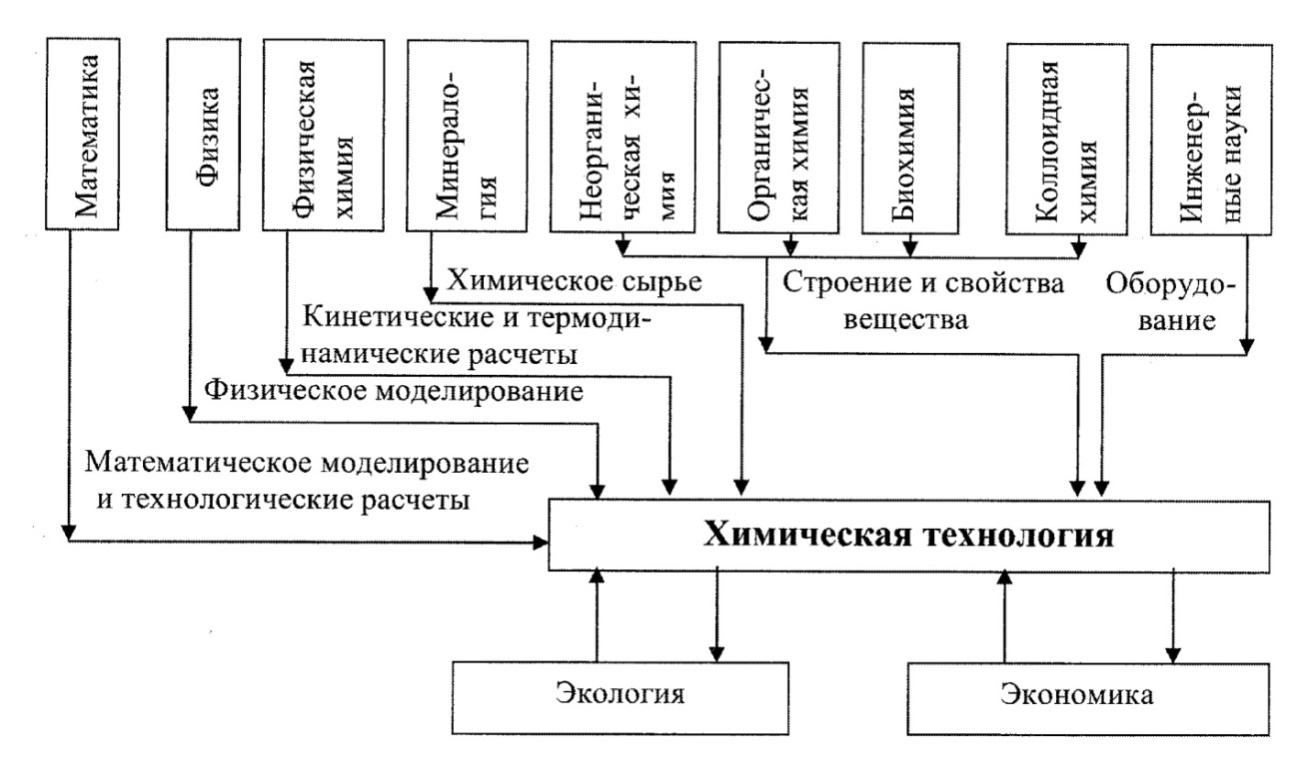
Рис. 1.1. Связь химической технологии с фундаментальными науками
1.3. Развитие химической технологии
Укрощение огня человеком стало отправной точкой в развитии прахимии и первичных ремёсел. Вода, огонь и природные материалы стали основой в освоении простейших производств, давших затем толчок к созданию первичной базы той науки, которую мы называем химией. Появились секреты искусства ремесла, передававшиеся по наследству, то есть то, что сегодня именуется технологией. Организационные формы первичных технологий совершенствовались по цепочке: ремесло – промысел – промышленность. Но основные компоненты оставались по сути теми же: сырьё – энергия (тепловая) – взаимодействие – разделение (очистка). Самым неизведанным, магическим звеном в этой цепочке были правила проведения процесса и механизм взаимодействия.
Люди античности знали и использовали многие продукты: серу, природную соду, уксус, зажигательные смеси, минеральные и растительные краски, растительные масла. В Древнем Китае было известно получение бумаги, красителей, сахара; финикийцы производили пурпур. Индейцы доколумбовых времён упаривали природные соки. Древние ремёсла включали все известные сегодня единичные процессы технологии – гидравлические, механические, тепловые, диффузионные, химические и биохимические. В XIV веке Европа узнала чёрный порох, изобретение которого связывают с именем монаха Бертольда Шварца.
Алхимики – египетские, китайские, арабские, европейские – не только закрепили в сознании человека термин «химия», известный по греческим письменным источникам с середины V века, не только произвели новые продукты – кислоты, соли и другие; они дали толчок развитию новых ветвей науки: химии благородных металлов и фармацевтической химии. Началась эпоха химии как науки, пришло время собирать, описывать, систематизировать, время анализа и синтеза на основе опыта древних ремёсел. Арабский алхимик Абу-ар-Рази в «Книге тайн» в Х веке описал различные химические аппараты и процессы, ввёл классификацию веществ на землистые (минеральные), растительные и животные. Описал кальцинацию (обжиг), растворение, сгущение, фильтрование, дистилляцию, амальгамирование. Пришло время технологии на уровне промыслов или мануфактур.
В России уже к середине XVI века известны промыслы по изготовлению пороха, красок, селитры, соды, серной кислоты, канифоли, воска и другие. К старинным российским промыслам, так или иначе причастным к химической технологии, следует отнести варку поваренной соли, обжиг древесного угля.
Во второй половине XVIII века устанавливаются качественно новые связи между химией и химическим производством: на базе фундаментальных наук рождается наука о химической технологии. Химическая промышленность в современном её понимании ведёт отсчёт от разработки в 1789 году французским химиком Лебланом метода получения синтетической соды по реакции (1.3):
Na2SO4 + 2C + CaCO3 = Na2CO3 + 2CO2 + CaS, (1.3)
что потребовало интенсивного развития производства серной кислоты для получения сульфата натрия по реакции (1.4).
2NaCl + H2SO4 = Na2SO4 + 2HCl. (1.4)
Возникла проблема утилизации хлороводорода – появилось производство соляной кислоты. Затем на промышленном уровне была решена проблема утилизации твёрдых и газообразных отходов в производстве соды (реакции 1.5, 1.6):
CaS + CO2 + H2O = CaCO3 + H2S, (1.5)
2H2S + 3O2 = 2H2O + 2SO2 (1.6)
и далее до получения серной кислоты. Процесс получился замкнутым по сере (Na2SO4 – CaS – H2S – SO2 – H2SO4 – Na2SO4) и с утилизацией выброса углекислого газа.
Расширение гаммы продуктов потребления, получаемых химическими способами, стремление получать более дешёвые продукты привело к созданию качественно новых, непрерывных, экономичных технологий. Проблемы, связанные с интенсификацией земледелия, вызвали к жизни создание технологий по производству минеральных удобрений сначала фосфатных, затем калийных и азотных. Последнее требовало простейшей переработки неограниченного по запасам сырья – азота воздуха. Синтез аммиака открыл новый этап развития химической технологии, когда от стехиометрических уравнений как базы создания процесса исследователи перешли к термодинамическим и кинетическим расчётам вероятности и скорости реализации технологических процессов.
В начале XIX века в России формируется система технологического образования. С 1804 года в университетах Москвы, Казани, Харькова создаются кафедры технологии, а с 1803 года в рабочем плане Петербургского педагогического института появился курс «Химическая технология», образован технологический кабинет. Фактически впервые курс «Химическая технология» начал читать профессор И.А. Двигубский в Московском университете в 1806 году. В 1837 году Петербургский технологический институт выпустил первую группу инженеров-химиков. В эти годы выходят первые русские учебники по химической технологии – прообразы будущего курса «Общая химическая технология». Первая специализированная химико-технологическая лаборатория была организована по проекту Р.Х. Геймана в Московском университете в 1834 году.
В конце XIX века в России шёл процесс концентрации химической промышленности, работали не только мелкие заводики, но и хорошо организованные производства основной химии, но в целом химическая промышленность ещё не играла заметной роли в экономике страны.
Мощный импульс развитию химической промышленности был дан в 1920 – 1932 годах: создана отрасль минеральных удобрений (включая производство серной, азотной кислот и аммиака), построены крупные заводы по выпуску химических волокон, синтетического каучука, строительных и оборонных материалов, пластмасс и синтетических смол. Следующий период интенсивной химизации народного хозяйства нашей страны был предпринят в 1959 – 1970 годах: огромные мощности были задействованы в производстве сложных и комплексных удобрений, нефтехимии, в производстве целлюлозы, цемента и других продуктов.
