- •Міністерство освіти і науки України
- •Модуль і
- •2. Правила роботи з реактивами
- •3. Правила техніки безпеки
- •4. Надання першої допомоги
- •2. Основні закони хімії
- •Приклади розв’язування задач
- •0,232 Г газу займає об’єм 0,2 л
- •Задачі та вправи
- •Заняття № 3 Тема: визначення еквівалентної маси металу
- •Питання для підготовки
- •Теоретичні відомості
- •Експериментальна частина
- •Виконання досліду
- •Тиск насиченої водяної пари в залежності від температури
- •Експериментальні дані
- •Розрахунки
- •Задачі та вправи
- •Заняття №4 Тема: будова атома
- •Питання для підготовки
- •Теоретичні відомості
- •Характеристика основних складових частин атома
- •Задачі та вправи
- •Заняття № 5 Тема: періодичний закон і періодична система елементів д.І. Менделєєва
- •Питання для підготовки
- •Теоретичні відомості
- •Задачі та вправи
- •Заняття № 6 Тема: основні класи неорганічних сполук
- •Питання для підготовки
- •Теоретичні відомості
- •1. Оксиди
- •Хімічні властивості
- •2. Основи
- •Хімічні властивості
- •3. Кислоти
- •4. Амфотерні гідроксиди
- •Експериментальна частина
- •Задачі та вправи
- •Заняття № 7 Тема: добування оксидів, кислот, основ та солей. Генетичний зв'язок між класами неорганічних сполук
- •Питання для підготовки
- •Теоретичні відомості
- •Задачі та вправи
- •Заняття № 8 Тема: хімічний зв’язок та властивості речовини
- •Питання для підготовки
- •Теоретичні відомості
- •Відносна електронегативність атомів
- •Класифікація кристалів за типом хімічного зв’язку
- •Задачі та вправи
- •1. Енергетика хімічних процесів
- •2. Хімічна спорідненість (напрям хімічних реакцій)
- •Приклади розв’язування задач
- •Задачі та вправи
- •Заняття № 10 Тема: швидкість хімічних реакцій. Хімічна рівновага
- •Питання для підготовки
- •Теоретичні відомості
- •1. Швидкість хімічних реакцій
- •2. Каталіз та каталізатори
- •3. Хімічна рівновага
- •Експериментальна частина
- •Результати досліду
- •Результати досліду
- •Задачі та вправи
- •Експериментальна частина
- •Приклади розв’язування задач
- •Задачі та вправи
- •Приклади розв’язування задач
- •Задачі та вправи
- •Заняття № 13 Тема: властивості розчинів. Закони рауля
- •Питання для підготовки
- •Теоретичні відомості
- •1. Розчини неелектролітів.
- •2. Розчини електролітів
- •Приклади розв’язування задач
- •Задачі та вправи
- •Заняття № 14 Модульна контрольна робота №1 приклад завдання
- •Експериментальна частина
- •Задачі та вправи
- •Задачі та вправи
- •Заняття № 17 Тема: електрохімічні процеси. Гальванічні елементи
- •Питання для підготовки
- •Теоретичні відомості
- •Експериментальна частина
- •Приклади розв’язування задач
- •Задачі та вправи
- •Заняття № 18 Тема: електроліз. Акумулятори
- •Питання для підготовки
- •Теоретичні відомості
- •Приклади розв’язування задач
- •Задачі та вправи
- •Експериментальна частина
- •Задачі та вправи
- •Приклади розв’язування задач
- •Експериментальна частина
- •Задачі та вправи
- •Заняття № 21 Тема: хімічні властивості неметалів
- •Питання для підготовки
- •Теоретичні відомості
- •Експериментальна частина
- •Задачі та вправи
- •1. Теорія хімічної будови о. Бутлерова.
- •2. Класифікація та номенклатура органічних сполук
- •Гомологічний ряд метану
- •3. Похідні вуглеводнів
- •Задачі та вправи
- •Задачі та вправи
- •Високомолекулярні сполуки, утворені методом полімеризації
- •Високомолекулярні сполуки, одержані методом поліконденсації
- •Експериментальна частина
- •Експериментальні дані, одержані внаслідок виконання дослідів
- •Задачі та вправи
- •Заняття № 25 Модульна контрольна робота №2 приклад завдання
- •Перелік питань, включених до екзаменаційних білетів
- •Додатки
- •Стандартні ентальпії , ентропії і енергії Гіббса утворення деяких речовин при ( )
- •Константи дисоціації деяких кислот і основ у водних розчинах
- •Розчинність у воді кислот, основ та солей
- •Стандартні електродні потенціали металів (електрохімічний ряд напруг)
- •Взаємодія з кислотами hCl, h2so4, hno3 металів
- •43018 М. Луцьк, вул. Львівська, 75
1. Теорія хімічної будови о. Бутлерова.
Органічна хімія – це хімія вуглеводнів – сполук Карбону і Гідрогену. Предметом органічної хімії є вивчення складу, будови, властивостей та різноманітних перетворень органічних речовин. Основою органічної хімії є теорія хімічної будови органічних сполук О.М. Бутлерова (1861 р.).
Основні положення
1. Атоми у молекулах сполучені один з одним у певній послідовності відповідно до їх валентності.
2. Хімічні та фізичні властивості речовин залежать не лише від кількісного і якісного складу, але й від порядку сполучення атомів у молекулі.
3. Атоми або групи атомів у молекулах взаємно впливають один на одного безпосередньо або через інші атоми.
4.
Валентність Карбону у органічних
сполуках (число можливих зв’язків)
рівна чотирьом. Атом Карбону знаходиться
у збудженому стані і має електронну
конфігурацію
![]() (чотири неспарених електрони).
(чотири неспарених електрони).
5. А томи
Карбону здатні сполучатись один з
одним, утворюючи карбонові ланцюги
необмеженої довжини за рахунок одинарних
томи
Карбону здатні сполучатись один з
одним, утворюючи карбонові ланцюги
необмеженої довжини за рахунок одинарних
![]() ,
подвійних
,
подвійних
![]() або потрійних
або потрійних
![]() зв’язків. Ланцюги з атомів Карбону
можуть бути відкритими, розгалуженими,
замкнутими.
зв’язків. Ланцюги з атомів Карбону
можуть бути відкритими, розгалуженими,
замкнутими.
2. Класифікація та номенклатура органічних сполук
Органічні сполуки утворюють гомологічні
ряди. Гомологічним рядом називається
послідовний ряд однотипних органічних
сполук, коли кожна наступна відрізняється
від попередньої на групу атомів
![]() ,
яку називають гомологічною різницею.
,
яку називають гомологічною різницею.
Склад будь якого члена
гомологічного ряду можна знайти за
допомогою загальних формул. Загальна
формула гомологічного ряду насичених
вуглеводнів – алканів –
![]() (таблиця 7), ненасичених з одним
подвійним зв’язком (етиленових) –
алкенів –
(таблиця 7), ненасичених з одним
подвійним зв’язком (етиленових) –
алкенів –
![]() (
(![]() етен (етилен),
етен (етилен),
![]() ,
пропен (пропілен)), ненасичених з двома
подвійними зв’язками (дієнових) –
алкадієнів
–
,
пропен (пропілен)), ненасичених з двома
подвійними зв’язками (дієнових) –
алкадієнів
–
![]() (
(![]() бутадієн-1,3),
ненасичених з одним
потрійним зв’язком (ацетиленових) –
алкінів
–
(
бутадієн-1,3),
ненасичених з одним
потрійним зв’язком (ацетиленових) –
алкінів
–
(![]() етин (ацетилен),
етин (ацетилен),
![]() пропін (метилацетилен)); загальна формула
бензену і його похідних – аренів
(ароматичних вуглеводнів)
пропін (метилацетилен)); загальна формула
бензену і його похідних – аренів
(ароматичних вуглеводнів)
![]() (n ≥ 6)
(
бензен (бензол)).
(n ≥ 6)
(
бензен (бензол)).
Вуглеводневими радикалами називають залишки, утворені послідовним відніманням від молекул вуглеводню атомів Гідрогену. Вони мають одну або кілька вільних валентностей. Нижче подані вуглеводні гомологічного ряду метану і відповідні їм радикали.
Таблиця 9
Гомологічний ряд метану
Насичені вуглеводні - алкани СnH2n+2 |
Одновалентні радикали |
Метан СН4 |
Метил СН3 — |
Етан С2Н6 |
Етил С2Н5 — |
Пропан С3Н8 |
Пропіл С3Н7 — |
Бутан С4Н10 |
Бутил С4Н9 — |
Пентан С5Н12 |
Аміл С5Н11 — |
Гексан С6Н14 |
Гексил С6Н13 — |
Гептан С7Н16 |
Гептил С7Н15 — |
Октан С8Н18 |
Октил С8Н17 — |
Нонан С9Н20 |
Нонил С9Н19 — |
Декан С10Н22 |
Децил С10Н21 — |
Номенклатура вуглеводнів
Назви органічних сполук утворюють згідно з правилами Міжнародного союзу чистої і прикладної хімії (ІЮПАК), які базуються, головним чином, на женевській номенклатурі.
1. Вибирають найдовший карбоновий ланцюг і нумерують атоми карбону з ближчого від розгалуження кінця.
2. Визначають бічні розгалуження і в алфавітному порядку називають їх, ставлячи перед ними цифру номера Карбону, при якому знаходиться даний радикал і називають головний ланцюг.

3-етил-2-метил гексан
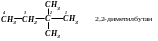
3. При наявності кратного зв’язку нумерацію атомів Карбону починають від того кінця, до якого ближче кратний зв’язок. Остання цифра відповідає номеру атома Карбону, біля якого знаходиться кратний зв'язок:
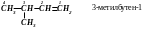
Хімічні властивості вуглеводнів
У хімічному відношенні насичені вуглеводні (алкани) за звичайних умов малоактивні. Для них характерні реакції:
- заміщення:
![]() ;
;
- горіння:
![]() (повне згоряння);
(повне згоряння);
![]() (неповне згоряння);
(неповне згоряння);
-
t![]() (термічна дисоціація)
(термічна дисоціація)
![]() (каталітичний
розпад)
(каталітичний
розпад)
Ненасичені вуглеводні (алкени, алкіни, алкадієни) хімічно активніші, ніж алкани. Для них характерні реакції:
- приєднання:
![]() (галогенування);
(галогенування);
![]() (гідрування);
(гідрування);
![]() (гідратація);
(гідратація);
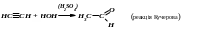
- окиснення в розчині:
етиленгліколь![]()
щавлева кислота![]()
- горіння:
![]() (повне горіння);
(повне горіння);
![]() (неповне
горіння);
(неповне
горіння);
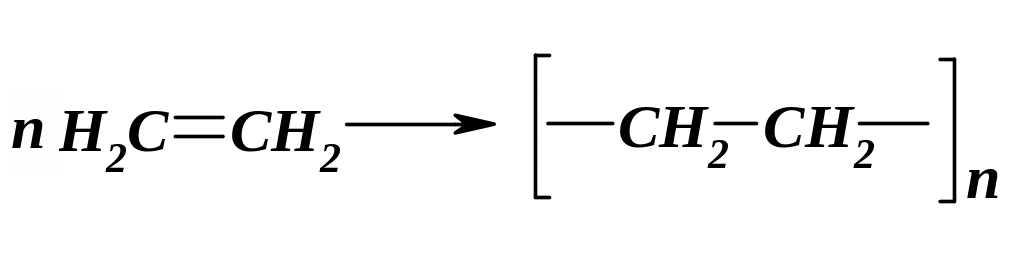
- полімеризації:
етилен
поліетилен