
Процесс выращивания микроорганизмов
Выращивание микроорганизмов в аэробных и анаэробных условиях оказывает влияние на соотношение липидных фракций. В анаэробных условиях образуются главным образом предшественники эргостерина, в частности сквален, а перевод микроорганизмов в аэробные условия вызывает ускоренный синтез стеринов и жирных кислот.
Выращивание микроорганизмов на питательных средах называется культивированием.
Выращивание микроорганизмов происходит в водной среде при аэрировании; при этом вода загрязняется органическими и минеральными веществами.
Выращивание микроорганизмов на газообразных углеводородах имеет ряд преимуществ по сравнению с выращиванием их на углеводном сырье. К ним относятся: отсутствие в газообразном сырье нежелательных примесей, исключающее необходимость дополнительной очистки готовой микробной биомассы, низкая стоимость сырья и хорошая его транспортабельность.
Для выращивания микроорганизмов, использующих органические формы азота, часто употребляют мясо-пептонные среды: мясо-пептонный бульон, мясо-пептонный агар и мясо-пептонную желатину.
Для выращивания микроорганизмов на поверхности увлажненного твердого субстрата обычно используют давно разработанный метод разведения их на отрубях, модифицированный известным ученым И.
Для выращивания микроорганизмов на жидких водорастворимых субстратах используются несложные по конструкции ферментаторы.
Для выращивания микроорганизмов на двух или более несмешивающихся жидкостях используются аппараты, обеспечивающие хорошее смешение компонентов субстрата и воздуха.
Для выращивания микроорганизмов на газообразных углеводородах используются аппараты с механическим перемешиванием среды.
Процесс выращивания микроорганизмов - продуцентов липидов - на гидролизатах верхового торфа малой степени разложения состоит из следующих операций: получения гидролизата торфа, отдувки фурфурола и нейтрализации гидролизата до рН 5.5 – 6.0, введения в гидролизат минеральных источников питания, выращивания дрожжей - продуцентов липидов, отделения биомассы и экстракции из нее липидов. Таким образом, весь этот процесс аналогичен процессу получения белковых препаратов, за исключением дополнительных операций, связанных с извлечением липидов.
Особенность выращивания микроорганизмов на природном газе состоит в том, что питательные вещества (природный газ и кислород) подаются в процесс в газообразном состоянии, и одним из основных факторов, определяющих его производительность, является массо-передающая характеристика применяемой аппаратуры.
Схемы двухступенчатого выращивания микроорганизмов внедрены на многих заводах. При этом на I ступени выращивают дрожжи, а на последрожжевой бражке - микроскопические грибы.
Технологическая схема стерилизации питательной среды
Существуют два основных способа стерилизации питательных сред – автоклавирование и фильтрование. В первом случае приготовленный раствор разливают в предварительно простерилизованную в сушильному шкафу посуду для культивирования, а затем стерилизуют в автоклаве при давлении 0,75–0,9 атм (температура 110-115°С) в течение 20-25 мин. Можно сначала методом автоклавирования простерилизовать большое количество среды в одном объеме, а затем в ламинарном боксе разлить ее в стерильную посуду для культивирования. Однако, на наш взгляд, последний вариант более трудоемок. Кроме того, при таком способе разлива среды увеличивается вероятность ее инфицирования. Подобная последовательность действий более приемлема при небольшом количестве среды.
Во втором случае используют стерильные фильтры Зейтца, Беркефельда, свечи Шамберлана, мембранные фильтры, незаменимые для приготовления сред с термолабильными компонентами (некоторые стимуляторы роста, витамины, антибиотики, аминокислоты, растительные экстракты), которые разрушаются при авто- клавировании. Фильтрация сред (холодная стерилизация) применяется также для приготовления смесей ферментов и выделения изолированных протопластов, сред с биологически активными компонентами, жидких сред.
Питательные среды, содержащие органические добавки, такие, как кокосовое молоко, картофельный отвар и пр., дезинфицируют путем фильтрования, используя специальные фильтры из диатомовой земли, плавленого стекла или сложных эфиров целлюлозы.
Однако полной стерилизации можно достичь лишь в процессе тиндализации, которую обычно проводят в аппарате Коха. Суть методики состоит в 2-3-кратном нагревании посуды водным паром до температуры 90-100°С с 24-часовыми интервалами. Первое нагревание приводит к уничтожению вегетативных форм, а последующие – к гибели микроорганизмов, которые образовались при температуре 25°С из склероция в перерывах между нагревами.
Тиндализацию также используют для стерилизации питательных сред, содержащих соединения, которые разрушаются при высоких температурах (например, гиббереллины инактивируются при температуре выше 90°С). То же относится и к сахарам, которые карамелизируются при высоких температурах.
Время термической дезинфекции зависит от объема посуды, в которую разлита питательная среда. Пробирки со средой стерилизуют 15 мин при температуре 115°С. Колбы, содержащие 100-500 мл питательной среды, дезинфицируют 30 мин при температуре 121°С и 45 мин при температуре 115°С. Колбы, в которых находится от 500 до 5000 мл питательной среды, стерилизуют в автоклаве в течение 35-40 мин при температуре 121°С и 50 мин при температуре 115°С.
Ф.Л. Калинин и соавт. (1992) рекомендуют следующую длительность стерилизации питательных сред в зависимости от их объема:
После окончания стерилизации среды в камере автоклава нужно постепенно уменьшать давление и температуру. Крышку автоклава необходимо открывать только после того, когда стрелка манометра установится на отметке “0”. В противном случае, при резком изменении давления, среда может моментально закипеть, выплескиваясь из сосудов, в которых проводилась стерилизация, и смачивать крышки (это может привести к дополнительному инфицированию). В то же время нужно следить за тем, чтобы автоклав был разгерметизирован в момент установления стрелки манометра на отметке “0”; иначе крышку автоклава может засосать вследствие формирования градиента давлений. Если это произошло, нужно кратковременно (на 1,5-2 мин) включить тумблер автоклава, после чего крышку стерилизационной камеры можно без усилий открыть.
Посуду с питательной средой после стерилизации помещают в специальный шкаф для хранения готовых питательных сред и выдерживают в течение 3-5 суток для выявления грибковой или бактериальной инфекции.
Стерилизационный аппарат
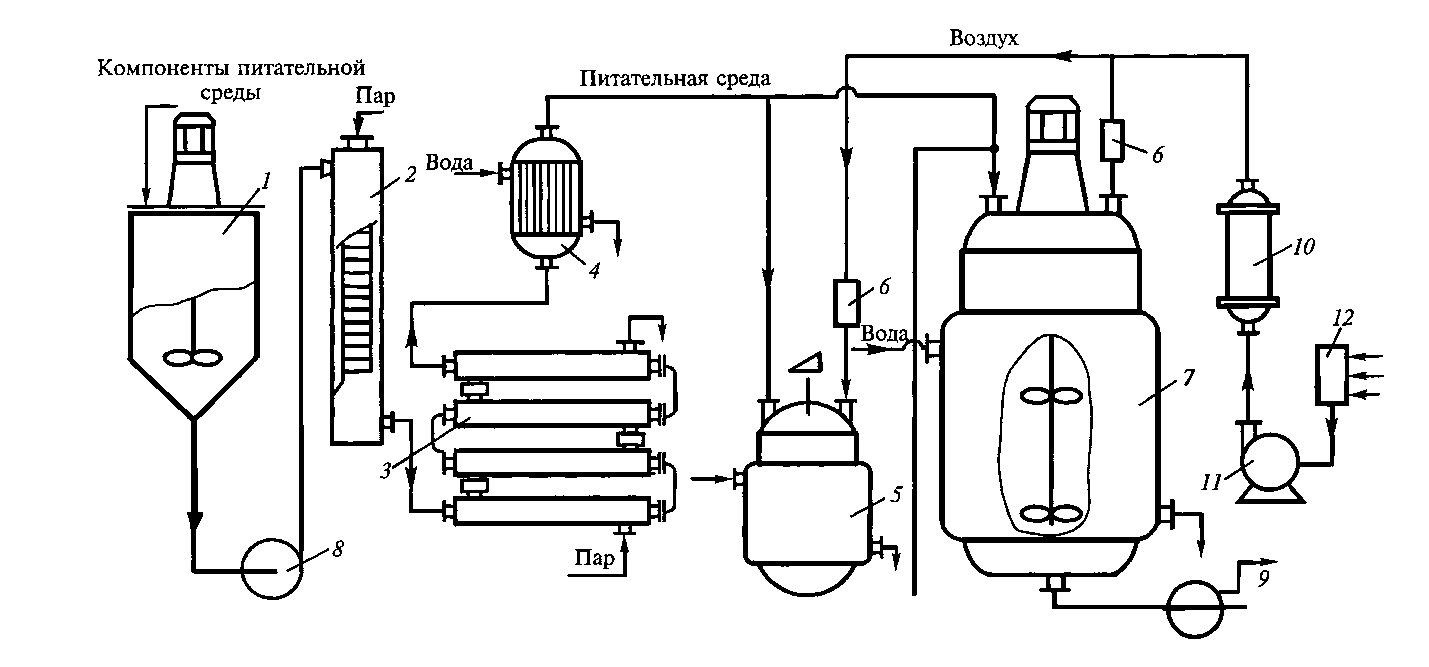
Аппаратурно-технологическая схема выращивания плесневелых грибов на барде спиртовых заводов
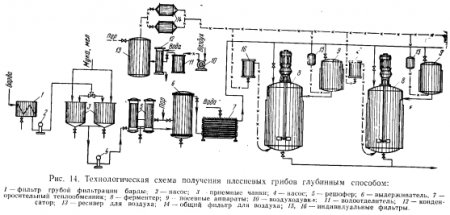
Исходную питательную среду (барду) из аппаратного отделения подают в барабанный фильтр 1 для отделения взвешенных веществ. Дробина направляется на бардораздаточный пункт, а фильтрат в сборники 5, в которых приготовляют питательную среду, добавляя в фильтрат муку и минеральные соли. Подготовленная среда плунжерным насосом 2 подается в стерилизатор 4, где нагревается через поверхность теплообменника до 130 С и направляется в выдерживатель 5 на 30 мин. Из выдерживателя среда поступает в теплообменник 6 для охлаждения до 30 С, н охлажденную среду направляют маточники 7 и ферментаторы 8. Вместимость маточника должна составлять 10% от массы среды в производственном ферментаторе. В процессе выращивания культуры в маточник подают стерильный воздух через форсунку диаметром 3 мм, вмонтированную в днище аппарата. При этом часовой расход воздуха составляет 15—20 м на 1 м культуральной жидкости. Готовая посевная культура из маточника поступает в ферментатор самотеком или же передавливается сжатым воздухом. В ферментаторе выращивание производственной культуры осуществляется при энергичном перемешивании механической мешалкой со скоростью 180 об/мин. Для 4 обеспечения потребности микроорганизмов в кислороде в ферментатор подают воздух через три форсунки диаметром 6 мм. В период максимального выделения биологического тепла в процессе развития микроорганизмов в рубашку ферментатора направляют воду для охлаждения. Готовая культуральная жидкость передается в сборники, из них в расходные чанкр для осахаривания. Воздух, подаваемый в маточники и ферментаторы, подвергают тщательной очистке от механических и бактериальных примесей. Из воздуходувки 11 воздух поступает в теплообменник 12 для охлаждения или нагревания до нужной температуры, ресивер 13, затем в общий фильтр 14, До входа в маточники и ферментаторы воздух проходит через индивидуальные фильтры 9 я 10 с тканью Петрянова, в которых он окончатель Рйс. 53. Подогреватель. НО очищается.
Испытательный центр по оценке качества продукции и услуг ГБПОУ НСО «Новосибирский химико-технологический колледж им. Д. И. Менделеева»
Направление деятельности:
Создание независимой технически компетентной базы для оценки качества и безопасности продукции и услуг, а также обеспечения интеграции инновационных образовательных, научно-исследовательских и промышленных предприятий различных форм собственности.
Основные объекты испытаний:
Пищевая продукция и продовольственное сырье;
Пищевые и биологически активные добавки;
Продукции общественного питания;
Продукция текстильной и легкой промышленности;
Посуды,
Тара;
Игрушки;
Изделий из бумаги бытового и санитарно-гигиенического назначения;
Парфюмерно-косметической продукции и средств гигиены полости рта.

Спектрофотометр – прибор для исследования свойств различных веществ на основе анализа спектрального состава отражённого излучения. Так же используется для измерения спектральных характеристик излучателей и объектов, взаимодействовавших с излучением, а также для спектрального анализа и фотометрирования.

Иономер предназначен для измерения показателя активности ионов водорода (рН) и других одновалентных и двухвалентных анионов и катионов, а так же массовой, молярной концентрации и массовой доли ионов, окислительно-восстановительного потенциала, электродвижущей силы электрохимических ячеек и температуры водных растворов.
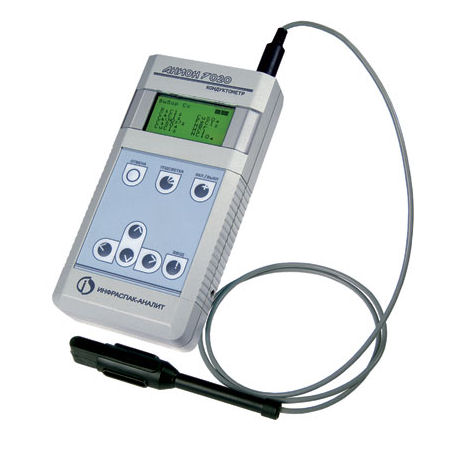
Кондуктометр – прибор для измерения электропроводности различных растворов, расплавов, а также твердых веществ. Кондуктометры применяются в промышленности и экологии для оценки качества воды, засоления почв, кондуктометрического титрования, а также в лабораторных исследованиях.

Газовая хроматография — разновидность хроматографии, в которой подвижной фазой служит инертный газ, протекающий через неподвижную фазу с большой поверхностью. В качестве подвижной фазы используют водород, гелий, азот, аргон, CO2.

Жидкостная хроматография– это хроматография, в которой подвижной фазой является жидкость.

Центрифуга (молочная) предназначена для определения массовой доли жира в молоке и молочных продуктах и массовой доли белка в молоке, а также для измерения растворимости сухих молочных продуктов.
