
- •Лабораторная работа №1 Тема: алкилирование бензола этиленом (пропиленом) Теоретические основы алкилирования
- •Цель работы
- •Методика выполнения работы
- •Анализ продуктов реакции
- •Приготовление катализаторного комплекса
- •Методика проведения эксперимента
- •Приготовление алюмохромового оксидного катализатора
- •Методика проведения эксперимента
- •Получение хлорида водорода
- •Анализ продуктов изомеризации
- •Методика проведения опыта
- •Анализ газов пиролиза
- •Анализ жидких продуктов пиролиза
- •Методика проведение опыта
- •Цель работы
- •Методика выполнения работы Реактивы
- •Контрольные вопросы
- •Литература
- •Описание лабораторной установки
- •Методика проведения лабораторной работы
- •Методика проведения анализов процесса
- •Литература
- •Лабораторная работа №8
- •Теоретическая часть
- •Методика проведения
- •Обработка результатов
- •Порядок выполнения работы
- •Определение потенциала ионизации растворителя деасфальтизации по растворимости гудрона в нём
- •Порядок выполнения работы
- •Контрольные вопросы
- •Техника безопасности в процессе гидратации ацетилена
- •Получение, очистка и анализ ацетилена
- •Аппаратура и методика проведения опыта
- •Методика выполнения работы
- •Тема: получение фенола и ацетона из изопропилбензола
- •Окисление изопропилбензола в гидропероксид
- •Методика выполнения работы
- •Методика выполнения работы
- •Приготовление катализаторного раствора
- •Выделение палладия из отработанного катализаторного раствора
- •Порядок выполнения работы
- •Контрольные вопросы
- •Литература
Тема: получение фенола и ацетона из изопропилбензола
Теоретические основы
Фенол и ацетон являются важными продуктами органического синтеза, которые широко используются в народном хозяйстве. Особенно многообразны области применения фенола, а именно: производство синтетических смол, пластических масс, синтетического волокна, поверхностно-активных веществ, средств защиты растений, лекарственных препаратов и др.
В настоящее время основным промышленным методом получения фенола является процесс окисления изопропилбензола в гидропероксид и разложение гидропероксида изолропилбензола на фенол и ацетон.
Процесс производства фенола и ацетона включает три основные стадии:
а) алкилирование бензола пропиленом в изопропилбензол
С6Н6+СН2=СНСН3 С6Н5СН(СН3)2
С6Н5СН(СН3)2
б) окисление изопропилбензола в гидропероксид
С6Н5-С(СН3)2+О2→С6Н5-С(СН3)2
| |
Н ООН
в) разложение гидропероксида изопропилбензола в фенол и ацетон
С6Н5-С(СН3)2→С6Н5ОН+СН3-С-СН3
| ||
ООН О
Цель работы
Изучение процессов окисления изопропилбензола в гидропероксид и разложения гидропероксида изопропилбензола в фенол и ацетон.
Окисление изопропилбензола в гидропероксид
В промышленности изопропилбензол окисляют в гидропероксид кислородом воздуха в тарельчатых колоннах непрерывного действия. Для устранения индукционного периода к изопропилбензолу, поступающему на окисление, добавляют до 1% гидропероксида и ведут окисление при 105—120°С и 0,4 МПа. Повышение температуры хотя и ускоряет процесс образования гидропероксида изопропилбензола, но одновременно приводит к усилению реакции его разложения, причем при температуре выше 120 °С реакция разложения может принять взрывной характер. Время реакции подбирают таким образом, чтобы глубина конверсии изопропилбензола не превышала 30—35%. В этом случае селективность процесса по гидропероксиду достигает ≈ 90%.
Основными побочными продуктами процесса окисления являются ацетофенон и диметилфенилкарбинол, которые образуются в результате дальнейших превращений гидропероксида изопропилбензола и гидропероксидного радикала:
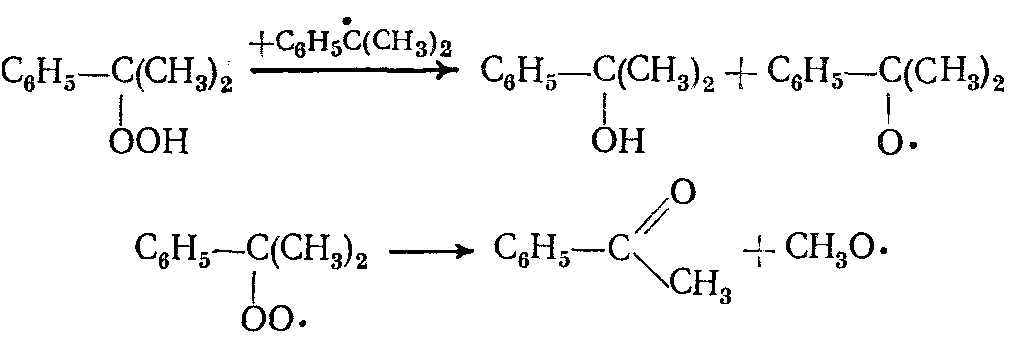
Поскольку процесс окисления протекает по радикально-цепному механизму, то изопропилбензол, поступающий на окисление, должен быть свободен от соединений серы, ненасыщенных углеводородов, фенола, стирола и других соединений, которые являются ингибиторами радикальных реакций.
Внимание! На всех стадиях получения и разложения гидропероксида изопропилбензола строго соблюдать правила работы с гидропероксидными соединениями, так как они легко взрываются.
Методика выполнения работы
Реактивы
Изопропилбензол 90,2 г (105 мл)
Гидропероксид изопропилбензола 2 г
Воздух или технический кислород (из баллона)
Уксусная кислота ледяная 200 мл
Иодид калия, 50%-ный водный раствор 50 мл
Тиосульфат натрия, 0,1 н. водный раствор 700 мл
Крахмал, водный раствор 40 мл
Изопропилбензол окисляют в гидропероксид на установке, схема которой приведена на рисунке 13. Установка состоит из игольчатого вентиля 1 для регулирования подачи сжатого воздуха, трубки 2 с активированным углем, трубки 3 с безводным хлоридом кальция, реометра 4 для измерения скорости подачи воздуха, предохранительной склянки 5, реактора 8, контактного термометра 9, обратного холодильника 10, сепаратора 11, реле-регулятора 14 и автотрансформатора 15. Перед началом опыта проверяют правильность сборки, герметичность всех соединений установки и надежность работы системы для поддержания в реакторе заданной температуры.
Реактор изготовлен из термостойкого стекла (d=24 мм, h = 250 мм) и снабжен барботером 7 для подачи воздуха, отводной трубкой с краном 13 для отбора проб, электроспиралью 6 для нагрева реакционной массы.
В сухой чистый реактор наливают 100 мл 3%-ного изопропилбензольного раствора гидропероксида изопропилбензола (или 100 мл изопропилбензола), 0,03 г стеарата кобальта и 0,03 г гидроксида кальция. Подают воду в обратный холодильник и включают обогрев реактора. По достижении в реакторе заданной температуры 115±0,5°С и стабилизации ее включают подачу воздуха со скоростью 800 мл/мин. Момент включения подачи воздуха принимают за начало опыта.
В ходе опыта каждые 30 мин в колбы емкостью 100 мл с притертыми пробками, предварительно взвешенные на аналитических весах, отбирают две параллельные пробы по 1 мл для определения концентрации гидропероксида изопропилбензола в реакционной массе. Перед отбором проб отводную трубку с краном 13 продувают воздухом при помощи резиновой груши.
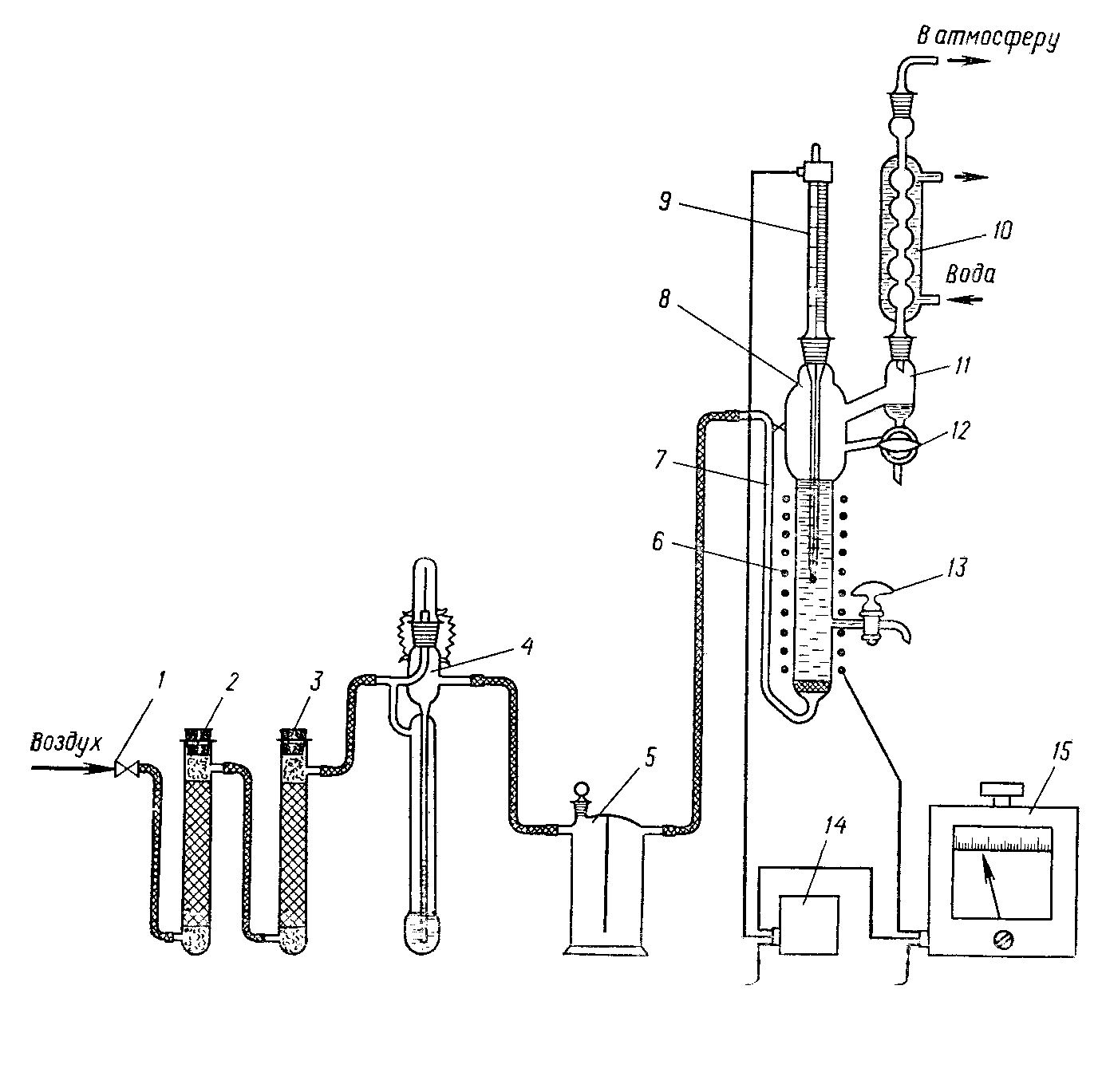
Рисунок 13 - Установка для окисления изопропилбензола в гидропероксид изопропилбензола:
1- игольчатый вентиль; 2 — трубка с активированным углем; 3 — трубка с безводным хлоридом кальция; 4 — реометр; 5 — предохранительная склянка; 6 — электроспираль; 7 — барботер; 8 — реактор; 9 — контактный термометр; 10 — обратный холодильник; 11 — сепаратор; 12 — трехходовой кран; 13 — кран; 14 — реле-регулятор; 15 — автотрансформатор.
Окисление изопропилбензола заканчивают по достижении концентрации гидропероксида в реакционной массе, ≈20% (масс.). Продолжительность опыта 3—4 ч. По окончании опыта выключают подачу воздуха, обогрев реактора и сразу отсоединяют линию воздуха от реактора для предотвращения засасывания в нее реакционной массы.
Реакционную массу после охлаждения выливают в предварительно взвешенную колбу емкостью 150 мл, определяют массу, состав и составляют материальный баланс опыта.
Массу продуктов реакции G1 в пересчете на изопропилбензол вычисляют по формуле:

Общую массу G2 взятых на анализ проб (gi) в пересчете на изопропилбензол вычисляют по формуле:

Потери изопропилбензола рассчитывают по формуле:

где М1, M2 — молекулярные массы изопропилбензола и гидропероксида изопропилбензола; gi — масса i-той пробы, г; yi — концентрация гидропероксида изопропилбензола в i-той пробе, % (масс.); п — число проб, взятых на анализ.
На основании полученных данных строят график зависимости: концентрация гидропероксида изопропилбензола (в % масс.) — продолжительность реакции (в мин); формулируют свои выводы о выполненной работе.
Контрольные вопросы
Применение фенола и ацетона в промышленности.
Стадии производства фенола и ацетона.
Формула по определению массы продуктов реакции.
Для чего в лабораторную установку включена трубка с безводным хлоридом кальция?
Литература
Одабашян Г.В. Лабораторный практикум по химии ТООНХС. М., Химия, 1982, с. 111-119.
Воскресенский П.И. Техника лабораторных работ. 10-е изд. М.. Химия, 1973, 717 с.
Лабораторная работа №14
Тема: ОКИСЛЕНИЕ ЭТИЛЕНА В АЦЕТАЛЬДЕГИД В ПРИСУТСТВИИ ХЛОРИДА ПАЛЛАДИЯ
Теоретические основы процесса
Процессы окисления олефинов с палладиевым катализатором относятся к новым перспективным методам получения некоторых карбонильных и винильных соединений. Среди этих методов большой интерес представляет окисление этилена в ацетальдегид, себестоимость которого по сравнению с другими известными методами его производства самая низкая.
Ацетальдегид является важным промежуточным продуктом, который производится в крупных масштабах и используется для получения уксусной кислоты, ангидрида уксусной кислоты, пентаэритрита и др.
Окисление этилена в ацетальдегид в водном растворе хлорида палладия в кислой среде протекает в две стадии:
СН2=СН2 +РdСl2+Н2О→СН3СНО+Рd+НСl
Рd+0,5О2+2НСl→ РdСl2+Н2О
Однако скорость второй реакции невелика, поэтому процесс окисления ведут в каталитическом растворе, содержащем PdCl2, CuCl2, HC1 и СНзСООН. В таком растворе палладий окисляется с достаточно высокой скоростью, так как перенос электронов от палладия к кислороду осуществляется через катион меди:
Рd+2Си2+Сl2→ Рd2+Сl2+2Си+Сl
2Си+Сl+0,5О2+2НСl→2Си2+Сl2+Н2О
Важна и роль уксусной кислоты — она препятствует выпадению хлорида меди в осадок.
В промышленности окисление этилена в ацетальдегид проводят в катализаторных растворах, содержащих 0,3—0,5% PdCl2, 10— 25% CuCl2, 2—3% Cu(OCOCH3)2 и НС1 (концентрация кислоты зависит от рН катализаторного раствора, который должен быть около 1,5), при 100—130°С и давлении 0,3—1,1 МПа.
Цель работы
Изучение влияния объемных скоростей подачи этилена и воздуха на выход ацетальдегида и на удельную производительность катализаторного раствора.
