
- •6 6.1. Основні фази в сплавах
- •§ 6.2. Особливості кристалізації сплавів
- •§ 6.3. Діаграми стану подвійних сплавів. Методи їхньої побудови
- •§ 6.4. Визначення складу і кількості фаз по діаграмі стану
- •§ 6.5. Різновиду типових діаграм стану двухкомпонентных сплавів
- •§ 6.6. Методичне керівництво для розбору діаграм стану сплавів
- •§ 6.7. Неравновесндя кристалізація і перекристалізація сплавів
- •§ 6.8. Зв'язок між діаграмами стану і можливістю термічної обробки сплавів
- •§ 6.9. Зв'язок між властивостями сплавів і типом діаграми стану. Фізико-хімічний закон н. С. Курнакова
§ 6.4. Визначення складу і кількості фаз по діаграмі стану
По діаграмі стану можна установити, чи є утвориться кристалічна фаза твердим розчином, хімічною сполукою або чистим компонентом. Для цього потрібно навчитися по діаграмах стану визначати склад фаз.
На мал. 6.3, а показана діаграма стану системи з компонентами А и В, аналогічна діаграмі стану системи Си —№.
Розглянемо процес кристалізації сплаву / складу крапки т'. Кристалізація починається при температурі Т\ у крапці т. Здавалося б, що склад кристалів, що утворяться при кристалізації сплаву /, повинний відповідати складу сплаву, тобто т'.
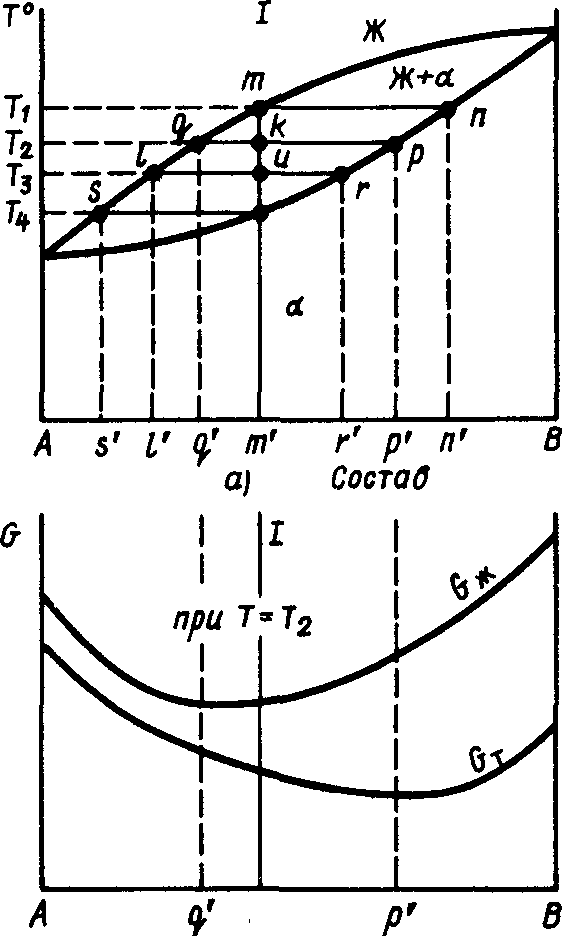
Таке твердження цілком випливає з закону несуперечності формальної логіки: справді, якщо виготовляється сплав складу т', те і кристали, що утворяться, повинні відповідати складу т''. Тепер ми підійшли до дуже важливого моменту, розібравши который стане ясно, що проходження правилам формальної логіки не завжди відбиває дійсне положення речей. Щоб бачити це, розглянемо сплав складу т' у крапці /м при температурі Гг. Міркуючи логічно, можна сказати, що при Га маються рідина складу т' і кристали того ж складу т'. Виникає питання: у чому ж розходження між кристалами і рідиною? Температура та сама, склад той самий, стало бути, ніякого розходження між рідиною і кристалами немає.
Якщо це так, то випливає явно неправильний висновок, що рідка фаза і кристали суть те саме. Однак з цим ніяк не можна
I),' т' Склад Ч) Рис. 6.3. Діаграма стану (а);
зміна термодинамічного потенціалу рідкої Ож і твердої Ст фаз у залежності від складу при температурі Тг (б)
погодитися. Таким чином, формальна логіка зайшла в суперечність з реальною дійсністю: рідина і кристали не є те саме! Вони повинні чимось відрізнятися. Потрібно дозволити виникле протиріччя, шукати, у чому розходження в цих фаз при даній температурі.
Закон термодинаміки показує, що стійким є такий стан, термодинамічний потенціал якого мінімальний. Тому що в сплаву т' при температурі Тч співіснують дві фази — кристали і рідина, те стійкими будуть фази, що мають мінімальне значення термодинамічного потенціалу. На мал. 6.3, б приведене значення термодинамічних потенціалів твердої Від і рідкої Сж фаз у залежності від складу при температурі Тч.
З графіка (мал. 6.3, б) видно, що має місце Ожччп при складі ц' і Сттт при складі р'. Це значить, що при Г г в крапці 1м стійкі будуть тверда фаза складу р' і рідка фаза складу ц'. Якщо ці склади спроецировать на лінії діаграми стану (мал. 6.3, а), то виявиться, що отримані крапки р і <? розташуються на горизонтальному відрізку, проведеному через крапку 1р. Проводячи такого ж дослідження, можна установити, що склад рідкої фази в крапці і буде Г, твердої — г'.
На основі викладеного можна вивести важливе правило:
для визначення рівноважного складу фаз у двухфазной області діаграми стану в заданій крапці, називаної фігуративної, необхідно через цю крапку провести горизонтальну лінію (іменовану конодой) до перетинання з лініями ліквідус і солідус діаграми стану.
Проекція крапки перетинання коноды з лінією ліквідус на концентраційну вісь визначає склад рідкої фази. Проекція крапки перетинання коноды з лінією солідус на концентраційну вісь визначає склад твердої фази.
№ 8. Який склад усіх кристалів, що утворилися в сплаву складу т' (мал. 6.3) при кристалізації й охолодженні в інтервалі температур Г| — Г4 після завершення рівноважної кристалізації? (Рівноважною кристалізацією називаємо такий процес, коли всі перетворення в сплаві устигли вчинитися.)
Відповідь: склад кристалів буде: 1) в інтервалі п'-т', див. с. 184; 2) дорівнює т', див. с. 184.
Незважаючи на те що склад фаз при кристалізації безупинно змінюється, при рівноважній кристалізації дифузійні процеси устигають вирівняти склад фаз, привівши їх у відповідність з діаграмою стану. Тому, наприклад, при Гз склад як що раніше випали кристалів, так і при цій температурі що кристалізуються відповідає крапці г'.
Таким чином, якби була можливість розрахувати і побудувати криві залежностей Сж==/(с) і Від==^(с) (з-концентрація) для досліджуваної системи при різних температурах, то можна було б теоретично побудувати діаграму стану. Однак поки це неможливо, тому що відсутні залежності термодинамічних характеристик сплавів від їхнього складу.
126
Як було встановлено (мал. 6.3), склад фази, що кристалізується, зі зниженням температури безупинно змінюється по лінії солідус. Тут і далі для стислості говориться про зміну складу фаз по відповідних лініях діаграми. (Однак потрібно пам'ятати, що установити дійсний склад фаз можна тільки проектуючи відповідні крапки на лінія.х діаграми на вісь концентрації.) Як видно з мал. 6.3 і 6.2, склад фази, що кристалізується, перемінний, тому дана фаза є твердий розчин.
Діаграми стану систем У (мал. 6.3), а також Си —№ (див. мал. 6.2) відповідають випадку, коли компонента сплавів необмежено розчиняються як у рідкому, так і у твердому стані.
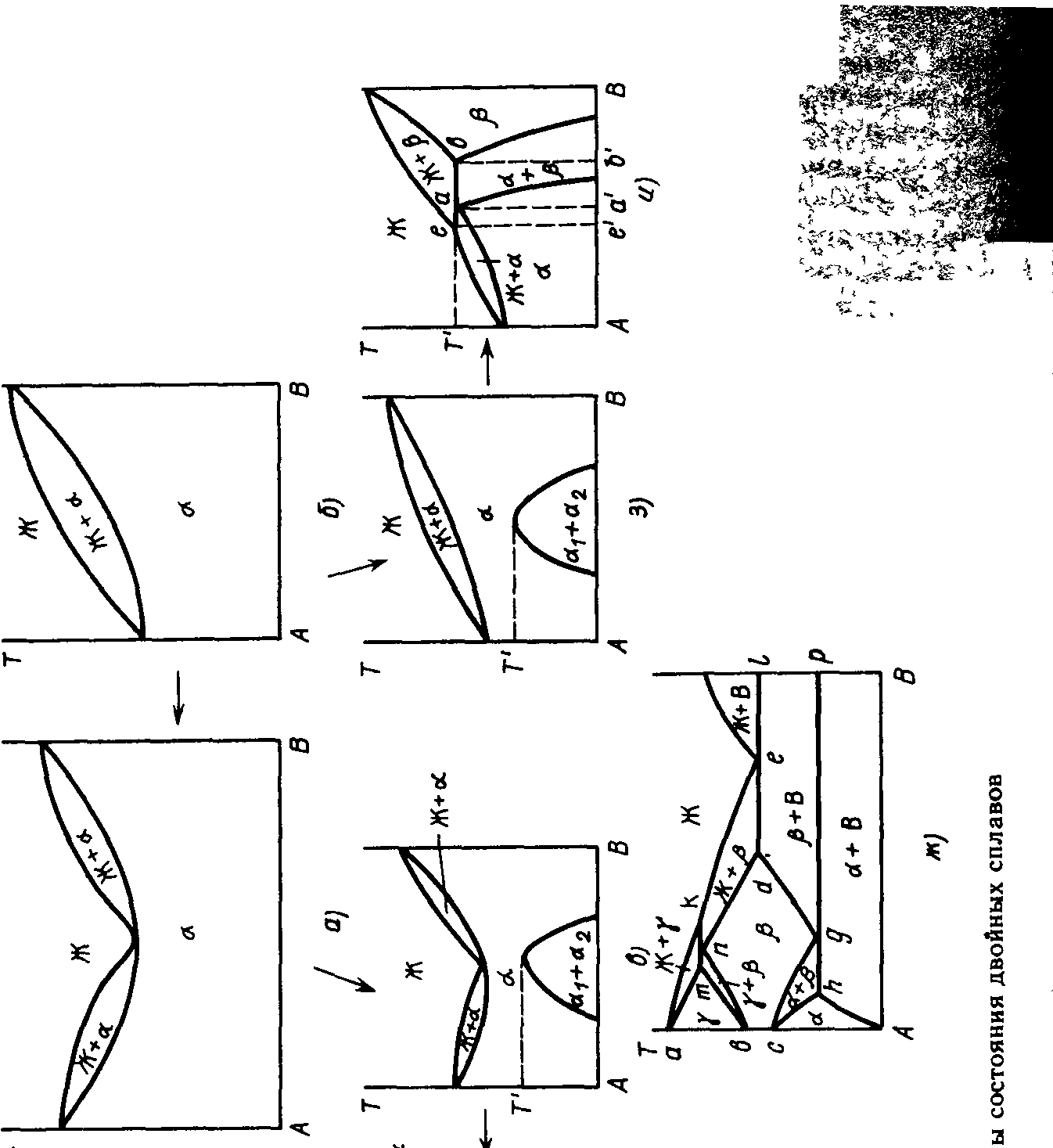
У тому випадку, коли при утворенні твердих розчинів температура кристалізації їх нижче температур кристалізації компонентів, то лінії ліквідус і солідус, що йдуть праворуч і ліворуч, знижуються і при якомусь складі зливаються, даючи загальну крапку мінімум. Вид діаграми стану в цьому випадку подібний діаграмі, показаної на мал. 6.4, а...і. Така діаграма утвориться, наприклад, у сплавів Ре-Сг (див. мал. 7.8).
Тверді розчини на діаграмах стану позначають малими буквами грецького алфавіту (а, р, у и т. д.), рідку фазу позначають буквою Ж. Як видно з мал. 6.3 і 6.4, полючи діаграми стану лініями ліквідус і солідус розділяються на фазові області Ж, Ж+а й а.
Визначення кількості фаз. Виведемо правило для визначення кількості фаз при будь-якій температурі сплаву в двухфазной області.
Нехай потрібно визначити кількість рідкої фази Ж и твердої фази а при температурі крапки /м сплаву складу т' (див. мал. 6.3, а). Якщо прийняти загальна кількість сплаву за одиницю, а кількість твердої фази (а-кристалів) позначити через х, то кількість рідкої фази буде (1-х). У сплаві А мається т % компонент У, що при температурі крапки /м розподіляється між рідкою і твердою фазами.
Кількість компонента В в рідкій фазі відповідає відрізку Пекло', а кількість компонента В в твердій фазі — відрізку Ар'.
Складемо рівняння щодо компонента В, кількість якого в сплаві / визначається відрізком Ат'. Його кількість у твердій фазі х-ар', а в рідкій фазі (1-х)Пекло'. Очевидно, що
хАр'+(1-х)Пекло'=Ат';
х(Ар'-А^/)=Ат'-А^',
але Ар'— Пекло'= р'^'= рд; Ат' -ад'==д'т'=1гц,
х^а=/гд/(р()), (6.1) тоді
1-х=Ж=1гр/(Ор). (6.2)
Залежності (6.1) і (6.2) дозволяють сформулювати правило для визначення кількості фаз у двухфазных областях.
Для визначення масової або об'ємної кількості фази в заданій крапці двухфазной області потрібно провести через цю крапку коноду і розділити довжину відрізка коноды, противолежащего складу даної фази, на загальну довжину коноды.
№ 9. Визначите кількість кристалів а при температурі Гз у крапці і. (мал. 6.3, а), якщо загальна кількість сплаву дорівнює 100 кг.
Відповідь: див. с. 184.
№ 10. Визначите кількість рідкої фази в сплаву складу 65 % № і 35 % Си (мал. 6.2, б) у крапці 2".
Відповідь: див. с. 184.
Важливо підкреслити, що правила для визначення складу і кількості фаз однакові для будь-який двухфазной області всіх діаграм стану. Слід зазначити, що діаграми стану реальних сплавів можуть бути досить складними. У цій главі створюється база для раскодирования інформації, що приводиться в графічній формі, перекладу її на звичайну розмовну мову.
Досвід показує, що розбір процесів, що відбуваються в сплавах, по діаграмах стану є украй важкою задачею, тому що неясно, чому при сплавці різних компонентів утворяться вкрай не однакові діаграми стану. Тому нижче розглядається, як це відбувається.
