- •1.Фізичні основи отримання низьких температур
- •1.1. Дроселювання
- •1.2. Розширення з одержанням зовнішньої роботи
- •1.3. Розширення без одержанням зовнішньої роботи
- •1.4. Вихровий ефект
- •1.5.Термоелектричний ефект
- •1.6.Термомагнітний ефект
- •1.7.Адіабатне розмагнічування парамагнетиків
- •2. Фазові перетворення в техніці низьких температур
- •3. Термодинамічні основи холодильних машин
- •3.1. Ідеальний газ та його властивості
- •3.2.Основні термодинамічні процеси
- •3.3. Поняття оборотності термодинамічних процесів. Внутрішня та зовнішня оборотність
- •3.4.Поняття циклу. Класифікація зворотних циклів
- •3.5. Другий закон термодинаміки. Оцінка необоротних втрат зворотних циклів
- •3.6. Оборотні зворотні цикли в умовах різноманітних зовнішніх джерела
- •4. Робочі речовини холодильних машин
- •4.1. Поняття холодильного агента. Історія використання
- •4.2.Позначення холодильних агентів
- •4.3. Екологічні аспекти використання холодильних агентів. Параметри оцінки впливу на довкілля
- •4.4. Термодинамічні властивості робочих речовин холодильних машин. Рівняння стану реальних газів і парів
- •4.5. Термодинамічна подібність
- •4.6. Вплив термодинамічних властивостей на необоротні втрати
- •4.7. Термодинамічні властивості розчинів
- •4.8. Основи теорії термодинамічної рівноваги розчинів
- •5. Цикли і схеми компресорних холодильних машин
- •5.1. Цикли і принципові схеми одноступеневих компресорних холодильних машин
- •5.1.1. Холодильна машина з детандером в області вологої пари
- •5.1.2. Холодильна машина з дроселюванням в області вологої та всмоктуванням сухої (перегрітої) пари
- •5.1.3. Цикл із стисканням робочої речовини по правій граничній кривій
- •5.1.4. Методи скорочення необоротних втрат у циклах компресорних холодильних машин
- •5.1.5. Методи скорочення необоротних втрат під час теплообміну
- •5.1.6. Методи скорочення необоротних втрат, пов’язаних із дроселюванням
- •5.1.7. Розрахунок одноступеневих холодильних машин
- •5.2. Цикли і принципові схеми багатоступеневих компресорних холодильних машин
- •5.2.1. Причини переходу до багатоступеневого стискання
- •5.2.2. Вплив багатоступеневого стискання і дроселювання на необоротні втрати в циклі
- •5.2.3. Вибір проміжного тиску
- •5.2.4. Цикли і схеми двохступеневих холодильних машин з одноразовим дроселюванням
- •5.2.5. Схеми двоступеневих холодильних машин із багаторазовим дроселюванням
- •5.2.6. Схеми та цикли триступеневих холодильних машин
- •5.2.7. Схеми та цикли каскадних холодильних машин
- •6. Газові холодильні машини
- •6.1. Теоретичний цикл нерегенеративної гхм з детандером
- •6.2. Теоретичні цикли регенеративних гхм із детандером
- •6.2.1. Замкнутий цикл
- •6.2.2. Розімкнуті цикли
- •7. Пароежекторні холодильні машини
- •7.1.Принцип дії та теоретичний процес пароежекторної холодильної машини
- •7.2. Особливості газодинамічних процесів у ежекторі
- •8.Абсорбційні холодильні машини
- •8.1.Схема та принцип дії абсорбційної холодильної машини
- •8.2. Водоаміачні абсорбційні холодильні машини (авхм)
- •8.2.1. Найпростіша холодильна машина
- •8.2.2. Тепловий розрахунок найпростішої машини аналітичним та графічним способом
- •8.2.3. Абсорбційна машина з теплообмінником розчинів
- •8.2.4. Ахм з теплообмінником розчинів та ректифікацією пари після генератора
- •8.2.5. Тепловий розрахунок авхм з теплообмінником розчинів та водяним дефлегматором графічним способом
- •8.2.6. Авхм із зворотним подавання розчину у генераторі та абсорбері
- •8.2.7. Парорідинний теплообмінник у схемі авхм
- •8.3.Вплив параметрів зовнішніх джерел на процеси та ефективність авхм
- •8.3.1. Вплив температури гарячого джерела
- •8.3.2.Вплив температури навколишнього середовища (охолодної води)
- •8.3.3 Вплив температури охолодного джерела
- •8.4. Абсорбційні бромистолітієві холодильні машини (абхм)
- •8.4.1. Одноступеневі абхм
- •8.4.2. Двоступеневі абхм
- •8.4.3. Енергетична ефективність абхм
- •8.5. Абсорбційно-резорбційні холодильні машини
- •8.5. Безнасосні абсорбційні холодильні машини
- •8.5.1. Абсорбційна бромистолітієва безнасосна холодильна машина
- •8.5.2. Абсорбційно-дифузійна водоаміачна безнасосна холодильна машина
- •8.24. Схема абсорбційно-дифузійного побутового холодильника
- •8.5.3. Абсорбційні безнасосні холодильні машини періодичної дії
- •9. Термоелектричні холодильні машини
- •9.1.Схема та цикл короткозамкненого термоелектричного ланцюга
- •9.2.Ефективність використання термоелектричного охолодження
- •Питання для підготовки до іспиту
- •Список літератури до курсу Основна
- •Додаткова
3. Термодинамічні основи холодильних машин
3.1. Ідеальний газ та його властивості
Ідеальним називається газ у якому молекули не пов’язані силами взаємного тяжіння та розмірами яких ми нехтуємо. Ідеальний газ є газом досконалим, він повністю підпорядковується газовим законам Бойля-Маріата та Гей-Люссака. Реальні гази відступають від вказаних законів, і якщо до них і застосовують ці закони, то при цьому допускають деяке наближення. Теплоємність реальних газів, на відміну від ідеального, є величина перемінна.
Для ідеальних газів справедливими є закони:
Закон Бойля-Маріотта:
В процесах, які протікають за постійної температури, тиск газу змінюється обернено пропорційно його об’єму (В процесах, які протікають за постійної температури, добуток тиску на питомий об’єм є величина постійна)
![]() або
або
![]() ; (3.1)
; (3.1)
Закон Гей-Люссака
В процесах, які протікають за постійного тиску, збільшення об’єму газу пропорційно підвищенню його температури (Відношення об’ємів газів в процесах, що протікають за постійного тиску, буде прямо пропорційно відношенню абсолютних температур)
![]() (3.2)
(3.2)
Закон Шарля
В процесах, які протікають за постійного об’єму, збільшення тиску газу пропорційно підвищенню його температури (Відношення тисків газу в процесах, що протікають за постійного об’єму, буде прямо пропорційно відношенню абсолютних температур)
![]() (3.3)
(3.3)
Об’єднаний закон Бойля-Маріотта та Гей-Люссака
Для процесів які протікають при зміні всіх параметрів справедливе твердження:
добуток тиску на об’єм поділені на абсолютну температуру, для будь-якого моменту процесу є величина постійна
![]() (3.4)
(3.4)
Наслідком законів Бойля-Маріотта і Гей-Люссака є характеристичне рівняння стану ідеального газу, виведене Клапейроном, що для 1кг газу має вигляд
, (3.5)
де р – абсолютний тиск газу, Па; –питомий об’єм газу, м3/кг; R – газова стала, для будь-якого газу R=8314/, Дж/(кг·К); µ – молекулярна маса газу, кг/кмоль; Т – абсолютна температура, К.
3.2.Основні термодинамічні процеси
Зміна стану 1кг газу, який визначається параметрами р, , Т, може відбуватися:
а) під впливом надання чи відведення теплоти;
б) від зовнішньої механічної дії.
Рівняння, що враховує всі зміни, які відбуваються в процесі зміни стану, має вигляд
![]()
![]() . (3.6)
. (3.6)
В рівнянні фігурує три фактори: теплота, внутрішня енергія та зовнішня механічна робота. В залежності від характеру та ступеня зміни вказаних факторів будемо мати різні умови протікання процесу. Розглянемо основні процеси.
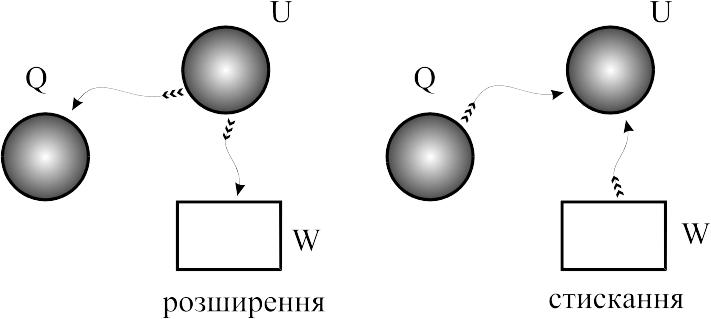
Процес
за постійного об’єму:
=сonst.
Для такого процесу справедливим є
рівняння Шарля (3.3). Тиск в процесі з
постійним об’ємом змінюється прямо
пропорційно температурі. Зовнішня
робота в таких процесах
![]() ,
оскільки об’єм не змінюється, а все
підведене тепло Q витрачається на зміну
внутрішньої енергії U. При відведенні
теплоти, відбувається зменшення
внутрішньої енергії. Наглядно ці процеси
можна відобразити рисунком:
,
оскільки об’єм не змінюється, а все
підведене тепло Q витрачається на зміну
внутрішньої енергії U. При відведенні
теплоти, відбувається зменшення
внутрішньої енергії. Наглядно ці процеси
можна відобразити рисунком:
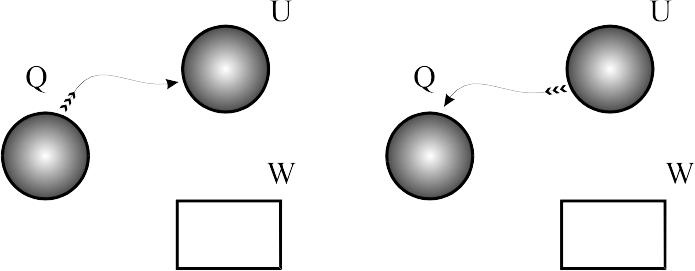
Процес
за постійного тиску:
р=сonst.
Для такого процесу справедливим є
рівняння Гей-Люсака (3.2). Об’єм в процесі
з постійним тиском змінюється прямо
пропорційно зміні абсолютних температур.
Зовнішня робота в таких процесах
![]() .
Так як температура газу при розширенні
збільшується, то збільшується і внутрішня
енергія. Отже теплота підведена в
ізобарних процесах витрачається на
виконання зовнішньої роботи і збільшення
внутрішньої енергії. При відведенні
теплоти відбуваються зворотні зміни.
.
Так як температура газу при розширенні
збільшується, то збільшується і внутрішня
енергія. Отже теплота підведена в
ізобарних процесах витрачається на
виконання зовнішньої роботи і збільшення
внутрішньої енергії. При відведенні
теплоти відбуваються зворотні зміни.
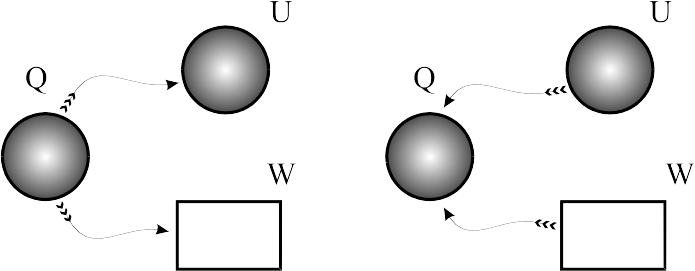
Процес за постійної температури: Т=сonst. Умови протікання ізотермічного процесу дозволяють скористатися рівнянням Бойля-Маріотта (3.1). Оскільки в таких процесах внутрішня енергія не змінюється, то вся підведена до газу теплота витрачається на виконання зовнішньої роботи. При відведенні теплоти буде виконуватися робота проти внутрішніх сил.
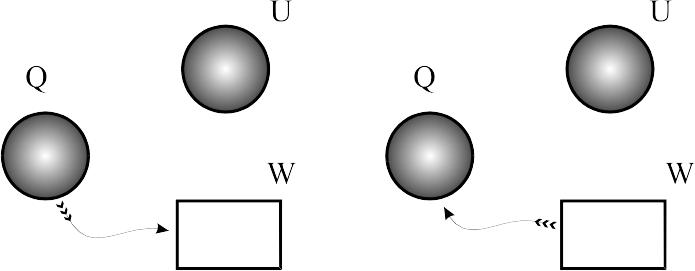
Адіабатний процес. Адіабатним називається процес, в якому не бере участь зовнішня теплота. Рівняння адіабатного процесу: рk=сonst. Тоді
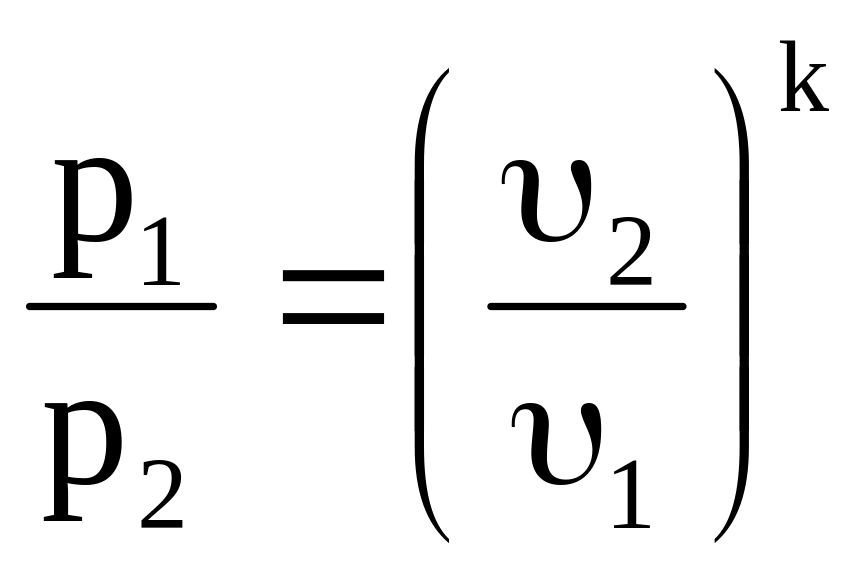 ,
,
 та
та
 . (3.7)
. (3.7)
В процесі адіабатного розширення зовнішня робота виконується завдяки зменшенню внутрішньої енергії, температура при цьому знижується. В процесі адіабатного стискання теплота, еквівалентна зовнішній роботі, витрачається на збільшення внутрішньої енергії, температура при цьому зроста.
Поряд з розглянутими процесами, можливі процеси, в яких не має таких наочно виражених ознак. Ми говорили, що підведена теплота витрачається на зміну внутрішньої енергії або на виконання зовнішньої роботи. Для різних процесів частка теплоти, що витрачається на зміну внутрішньої енергії, набуває свого особливого числового значення. Процеси, що протікають таким чином називаються політропними. Розглянемо ізотермічний та адіабатний процеси. Вони різняться корінним чином. У першому випадку вся підведена теплота витрачається на виконання зовнішньої роботи, а внутрішня енергія не змінюється, в другому - вся робота виконується за рахунок внутрішньої енергії, а надходження теплоти відсутнє. Між цими процесами легко уявити цілий ряд політропних процесів які будуть носити деякий проміжний характер. Оскільки крайні випадки процесів описуються схожими рівняннями: р=сonst та рk=сonst то логічно зробити висновок, що всі проміжні процеси можуть бути описані схожим рівнянням рn=сonst, при цьому для кожного з них, частка теплоти, що витрачається на зміну внутрішньої енергії, буде своя, і, отже, кожний процес буде мати свій відповідний показник степені n.
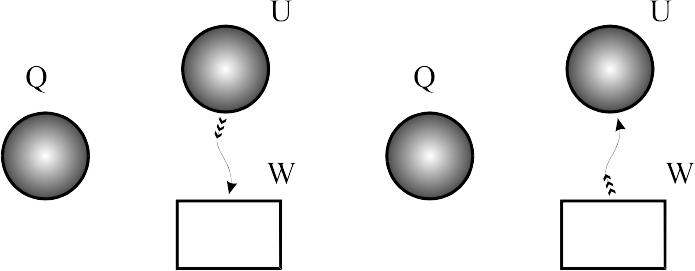
А оскільки n може змінюватися від 0 до , то всі процеси можуть розглядатися як політропні, з певним показником степені. Так при n=0 p=const – процес ізобарний; при n=1 р=сonst – ізотермічний; при n= – ізохорний; при n=k – адіабатний. В залежності від величини n процеси можуть протікати при збільшенні, зменшенні чи незмінній внутрішній енергії. Якщо n<1, то в процесі розширення з припливом теплоти виконується робота та збільшується внутрішня енергія, при стисканні – відводиться теплота і зменшується внутрішня енергія.
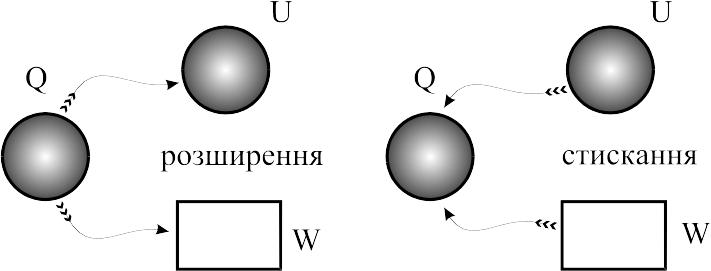
Якщо 1<n<k (k=1,4 для двоатомних газів), то при розширенні з припливом теплоти виконується робота та зменшується внутрішня енергія, при стисканні – відводиться теплота і збільшується внутрішня енергія.
Якщо n>k, то за рахунок внутрішньої енергії виконується робота та теплота віддається зовнішньому джерелу; за рахунок виконання роботи та підведення теплоти зростає внутрішня енергія.