
- •1.Фізичні основи отримання низьких температур
- •1.1. Дроселювання
- •1.2. Розширення з одержанням зовнішньої роботи
- •1.3. Розширення без одержанням зовнішньої роботи
- •1.4. Вихровий ефект
- •1.5.Термоелектричний ефект
- •1.6.Термомагнітний ефект
- •1.7.Адіабатне розмагнічування парамагнетиків
- •2. Фазові перетворення в техніці низьких температур
- •3. Термодинамічні основи холодильних машин
- •3.1. Ідеальний газ та його властивості
- •3.2.Основні термодинамічні процеси
- •3.3. Поняття оборотності термодинамічних процесів. Внутрішня та зовнішня оборотність
- •3.4.Поняття циклу. Класифікація зворотних циклів
- •3.5. Другий закон термодинаміки. Оцінка необоротних втрат зворотних циклів
- •3.6. Оборотні зворотні цикли в умовах різноманітних зовнішніх джерела
- •4. Робочі речовини холодильних машин
- •4.1. Поняття холодильного агента. Історія використання
- •4.2.Позначення холодильних агентів
- •4.3. Екологічні аспекти використання холодильних агентів. Параметри оцінки впливу на довкілля
- •4.4. Термодинамічні властивості робочих речовин холодильних машин. Рівняння стану реальних газів і парів
- •4.5. Термодинамічна подібність
- •4.6. Вплив термодинамічних властивостей на необоротні втрати
- •4.7. Термодинамічні властивості розчинів
- •4.8. Основи теорії термодинамічної рівноваги розчинів
- •5. Цикли і схеми компресорних холодильних машин
- •5.1. Цикли і принципові схеми одноступеневих компресорних холодильних машин
- •5.1.1. Холодильна машина з детандером в області вологої пари
- •5.1.2. Холодильна машина з дроселюванням в області вологої та всмоктуванням сухої (перегрітої) пари
- •5.1.3. Цикл із стисканням робочої речовини по правій граничній кривій
- •5.1.4. Методи скорочення необоротних втрат у циклах компресорних холодильних машин
- •5.1.5. Методи скорочення необоротних втрат під час теплообміну
- •5.1.6. Методи скорочення необоротних втрат, пов’язаних із дроселюванням
- •5.1.7. Розрахунок одноступеневих холодильних машин
- •5.2. Цикли і принципові схеми багатоступеневих компресорних холодильних машин
- •5.2.1. Причини переходу до багатоступеневого стискання
- •5.2.2. Вплив багатоступеневого стискання і дроселювання на необоротні втрати в циклі
- •5.2.3. Вибір проміжного тиску
- •5.2.4. Цикли і схеми двохступеневих холодильних машин з одноразовим дроселюванням
- •5.2.5. Схеми двоступеневих холодильних машин із багаторазовим дроселюванням
- •5.2.6. Схеми та цикли триступеневих холодильних машин
- •5.2.7. Схеми та цикли каскадних холодильних машин
- •6. Газові холодильні машини
- •6.1. Теоретичний цикл нерегенеративної гхм з детандером
- •6.2. Теоретичні цикли регенеративних гхм із детандером
- •6.2.1. Замкнутий цикл
- •6.2.2. Розімкнуті цикли
- •7. Пароежекторні холодильні машини
- •7.1.Принцип дії та теоретичний процес пароежекторної холодильної машини
- •7.2. Особливості газодинамічних процесів у ежекторі
- •8.Абсорбційні холодильні машини
- •8.1.Схема та принцип дії абсорбційної холодильної машини
- •8.2. Водоаміачні абсорбційні холодильні машини (авхм)
- •8.2.1. Найпростіша холодильна машина
- •8.2.2. Тепловий розрахунок найпростішої машини аналітичним та графічним способом
- •8.2.3. Абсорбційна машина з теплообмінником розчинів
- •8.2.4. Ахм з теплообмінником розчинів та ректифікацією пари після генератора
- •8.2.5. Тепловий розрахунок авхм з теплообмінником розчинів та водяним дефлегматором графічним способом
- •8.2.6. Авхм із зворотним подавання розчину у генераторі та абсорбері
- •8.2.7. Парорідинний теплообмінник у схемі авхм
- •8.3.Вплив параметрів зовнішніх джерел на процеси та ефективність авхм
- •8.3.1. Вплив температури гарячого джерела
- •8.3.2.Вплив температури навколишнього середовища (охолодної води)
- •8.3.3 Вплив температури охолодного джерела
- •8.4. Абсорбційні бромистолітієві холодильні машини (абхм)
- •8.4.1. Одноступеневі абхм
- •8.4.2. Двоступеневі абхм
- •8.4.3. Енергетична ефективність абхм
- •8.5. Абсорбційно-резорбційні холодильні машини
- •8.5. Безнасосні абсорбційні холодильні машини
- •8.5.1. Абсорбційна бромистолітієва безнасосна холодильна машина
- •8.5.2. Абсорбційно-дифузійна водоаміачна безнасосна холодильна машина
- •8.24. Схема абсорбційно-дифузійного побутового холодильника
- •8.5.3. Абсорбційні безнасосні холодильні машини періодичної дії
- •9. Термоелектричні холодильні машини
- •9.1.Схема та цикл короткозамкненого термоелектричного ланцюга
- •9.2.Ефективність використання термоелектричного охолодження
- •Питання для підготовки до іспиту
- •Список літератури до курсу Основна
- •Додаткова
1.7.Адіабатне розмагнічування парамагнетиків
У.Джіок та П.Дебай запропонували спосіб магнітного охолодження: використовувати замість газу парамагнітні солі (церієво-магнієвий нітрат, залізоамонієві та хромокалієві галуни, мідно-калієвий та залізоамонієвий сульфати, сульфат гадолінію та ін.), а замість тиску (для впорядкування молекул) – магнітне поле. За його відсутності молекули або магнітні іони (диполі) орієнтовані довільно. Для такого охолодження зразок розміщують у вакуумі і за допомогою сильного магнітного поля намагнічують, в результаті чого диполі впорядковуються, орієнтуючись за силовими лініями, зменшуючи ентропію матеріалу. Теплота, що виділяється при цьому відводиться (наприклад зрідженим гелієм). Якщо після цього теплоізолювати парамагнетик і зняти магнітне поле у адіабатному процесі (аналог адіабатного розширення газу), то впорядкованість диполів зменшиться. Для збереження сталої ентропії цей процес мусить супроводжуватись падінням температури. У такий спосіб досягають температур порядку 10-2...10-3 К.
Для отримання особливо низьких температур (10-4...10-9 К) використовують адіабатичне розмагнічування ядер (металічної міді та ін).
Для адіабатного процесу ентропія системи s=f(p,T,H), а магнітокалоричне рівняння
![]() . (1.50)
. (1.50)
Нехтуючи зміною тиску, вплив якого на тверде тіло малий, можемо отримати формулу для визначення швидкості зміни температури під час адіабатного розмагнічування
 . (1.51)
. (1.51)
За
дослідними даними
![]() ,
а величина
,
а величина
![]() .
Під час адіабатного намагнічування
парамагнітної речовини
.
Під час адіабатного намагнічування
парамагнітної речовини
![]() і температура його зростає –
і температура його зростає –
![]() .
Для випадку адіабатного розмагнічування
.
Для випадку адіабатного розмагнічування
![]() і температура знижується –
і температура знижується –
![]() :
:
 . (1.52)
. (1.52)
2. Фазові перетворення в техніці низьких температур
Фізичні тіла у природі можуть існувати в кількох різних агрегатних станах, які називаються фазами. Агрегатний стан речовини (твердий, рідкий, газоподібний, плазма та антипод плазми) залежить від зовнішніх умов – температури t і тиску р.
В 2001 році Нобелівська премія в галузі фізики була присуджена американцям Е.Корнеллу і К.Віману, а також німцю В.Кеттерле за відкриття передбаченого А.Ейнштейном у 1925 році п’ятого агрегатного стану. Вони експериментально підтвердили гіпотезу, отримавши конденсат, що виникає під час охолодження речовини до 0,000000002 К. Американці в Об’єднаному інституті астрофізичних лабораторій в штаті Колорадо дякуючи точному наведенню лазера на розміщений у скляному посуді газоподібний рубіній досягли такого стану речовини, при якому рух атомів практично зупинився (зникла взаємодія між ними). Німецький вчений в Масачусетському технологічному інституті проводив досліди з газоподібним натрієм. Йому вдалося отримати більшу кількість атомів і більш детально вивчити феномен. При цьому енергія атомів є однаковою та не змінюється.
При зміні цих умов форма зв’язку між молекулами в тілі змінюється і воно переходить в інший агрегатний стан. Перехід однорідного тіла з одного агрегатного стану в інший називається фазовим перетворенням. Фазові перетворення однорідних тіл відбуваються при постійній температурі, що залежить від умов переходу і фізичних властивостей тіла, і супроводжуються виділенням або поглинанням прихованої теплоти, що витрачається на зміну зв’язку між молекулами. Сам перехід супроводжується стрибкоподібною зміною параметрів речовини.
Перехід з рідкого стану у газоподібний називається випаровуванням, з твердого в рідкий – плавленням, з твердого у газоподібний – сублімацією. Ці процеси супроводжуються поглинанням теплоти і можуть бути використані для отримання низьких температур.
Зворотні переходи називаються відповідно: конденсацією, кристалізацією, десублімацією. Вони супроводжуються виділенням теплоти.
Процеси
зміни агрегатного стану тіла можемо
побачити на рис.2.1, фазової діаграми
вуглекислоти. У діаграмі лінія АБ
розділяє області твердої речовини і
газу, лінія АВ – області твердої речовини
і рідини, лінія АГ – області рідини і
газу. В окремих точках ліній АБ, АВ, АГ
тіло може бути одночасно в двох фазах:
твердій і газоподібній, твердій і рідкій,
рідкій і газоподібній. У точці А (потрійна
точка) речовина може бути в трьох фазах:
твердій, рідкій і газоподібній. Такий
стан називається евтектичним. Параметри
потрійної точки залежать від фізичних
властивостей речовини. Якщо
![]() (точка Г – критична) залишається лише
газоподібна фаза.
(точка Г – критична) залишається лише
газоподібна фаза.
Фазові перетворення не супроводжуються хімічними змінами, а є фізичними процесами. Деякі речовини при цих перетвореннях (плавленні, кипінні, сублімації) поглинають відносно великі кількості теплоти при низькій температурі, що дозволяє застосовувати їх для одержання охолодного ефекту.
При зміні стану має місце перехід з одного стану в інший. Внутрішня енергія такої системи з перемінною масою залежить не лише від S та V, але і від кількості речовини, яка визначається числом молей N:
![]() , (2.1)
, (2.1)
де µ- хімічний потенціал речовини. Він може бути виражений наступним чином:
через внутрішню енергію
 ;
;через ентальпію
 ;
;через вільну енергію
 .
.
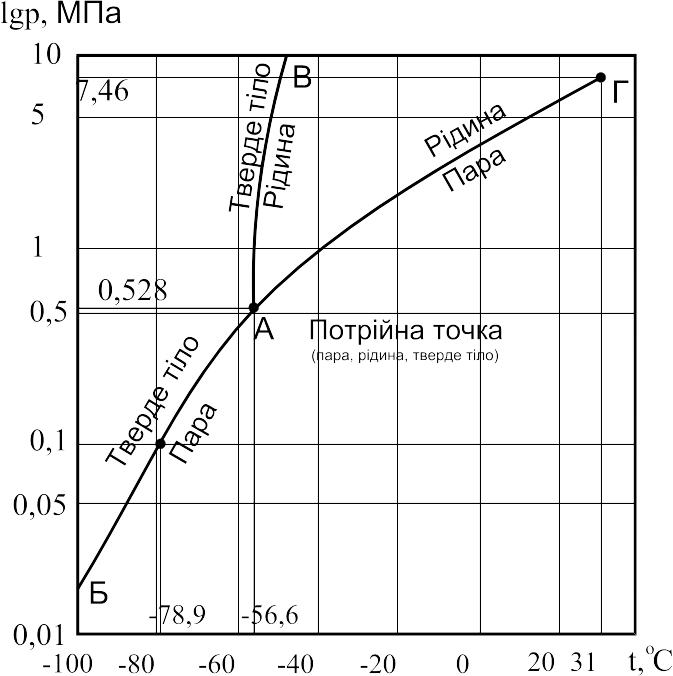
Рис.2.1. Діаграма рівноваги фаз вуглекислоти
Умовою
фазової рівноваги є рівність тисків,
температур та хімічних потенціалів
обох фаз:
![]() ;
;
![]() ;
;
![]() .
Таким чином, для потоку речовини із
однієї фази в іншу, хімічний потенціал
відіграє ту ж роль, яку температура
відіграє для потоку теплоти, чи тиск
для потоку газу в процесах становлення
рівноважного стану речовини (теплового
чи механічного). Потік речовини направлений
від фази з більшим хімічним потенціалом
до фази з меншим хімічним потенціалом
і припиняється коли вони зрівняються:
.
Таким чином, для потоку речовини із
однієї фази в іншу, хімічний потенціал
відіграє ту ж роль, яку температура
відіграє для потоку теплоти, чи тиск
для потоку газу в процесах становлення
рівноважного стану речовини (теплового
чи механічного). Потік речовини направлений
від фази з більшим хімічним потенціалом
до фази з меншим хімічним потенціалом
і припиняється коли вони зрівняються:
![]() . (2.2)
. (2.2)
Для випадку систем, які складаються з і-компонентів умова фазового переходу та рівноваги фаз запишеться:
![]() . (2.3)
. (2.3)
Якщо компонент у газовій фазі підкоряється законам ідеального газу, то умовою його фазової рівноваги може слугувати рівність парціальних тисків насичених парів у фазі (1) та (2).
Термодинамічний розгляд рівноваги чистої речовини в двох фазах однокомпонентної системи приводить до рівняння Клапейрона-Клазіуса:
![]() , (2.4)
, (2.4)
де
![]() -
похідна, що характеризує зміну тиску
насичення фазового переходу;
-
похідна, що характеризує зміну тиску
насичення фазового переходу;
![]() -
температура
фазового переходу;
-
температура
фазового переходу;
![]() -
питома теплота фазового переходу;
-
питома теплота фазового переходу;
![]() -
зміна питомого об’єму речовини при
фазовому переході.
-
зміна питомого об’єму речовини при
фазовому переході.
Оскільки
![]() ,
,
![]() ,
то знак
буде залежати лише від знака
.
У випадку випаровування та сублімації,
коли
>0,
(питомий об’єм газу значно більший ніж
твердого тіла чи рідини) отримуємо
>0.
Відповідно із зростанням тиску буде
зростати температура фазового переходу
і навпаки. У випадку плавлення можуть
мати місце два випадки, залежно від
речовини. Так, для більшості речовин,
так званих “нормальних”,
>0,
відповідно для них з ростом тиску зростає
температура плавлення і навпаки. Однак
для деяких (“анормальних”)
<0
і з ростом тиску температура плавлення
буде знижуватися. До таких речовин
належить вода, вісмут, гелій та деякі
інші. Однак в обох випадках температура
плавлення мало залежить від тиску, в
той час як температура випаровування
та сублімації залежить суттєво.
,
то знак
буде залежати лише від знака
.
У випадку випаровування та сублімації,
коли
>0,
(питомий об’єм газу значно більший ніж
твердого тіла чи рідини) отримуємо
>0.
Відповідно із зростанням тиску буде
зростати температура фазового переходу
і навпаки. У випадку плавлення можуть
мати місце два випадки, залежно від
речовини. Так, для більшості речовин,
так званих “нормальних”,
>0,
відповідно для них з ростом тиску зростає
температура плавлення і навпаки. Однак
для деяких (“анормальних”)
<0
і з ростом тиску температура плавлення
буде знижуватися. До таких речовин
належить вода, вісмут, гелій та деякі
інші. Однак в обох випадках температура
плавлення мало залежить від тиску, в
той час як температура випаровування
та сублімації залежить суттєво.
Плавлення. Плавлення водяного льоду за нормальних умов проходить при температурі 0º С і широко використовується у випадку необхідності отримання температур, близьких до температури плавлення (торгівля, акумулювання холоду в системах з проміжним теплоносієм, кондиціонуванні повітря тощо). Для одержання більш низьких температур у лід або сніг додають солі, що дозволяє знизити температуру плавлення. Суміші готують із речовин, які у процесі розчинення поглинають теплоту. Сіль і вода утворюють подвійну систему, процеси зміни стану компонентів А і В якої подано на рис.2.2, у координатах Т-n (температура-концентрація). При охолодженні розчину складу “а” спочатку його температура знижується за постійної концентрації до точки “b”, у якій починають утворюватися кристали компонента А, що плавають у рідині В. При подальшому охолодженні процес проходить по лінії від точки “b” до точки К, в якій починається і закінчується кристалізація компонента В. Розчин складу nк відрізняється від всіх інших тим, що він замерзає при постійній температурі, найбільш низькій для даних компонентів. Ця температура називається евтектичною або кріогідратною.
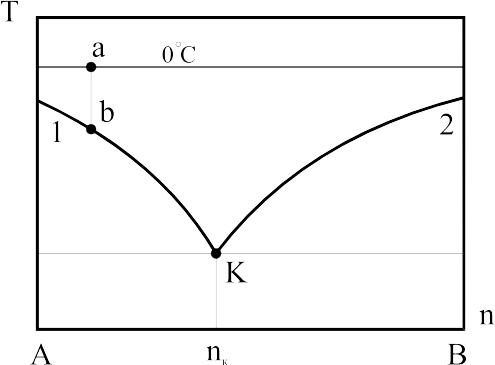
Рис.2.2. Діаграма фазової рівноваги подвійної системи “вода-сіль”
Найбільше поширені суміші для охолодження – хлористий натрій (NaCl) із льодом (до -21,2ºС) і хлористий кальцій (CaCl2) із льодом (до - 55ºС).
Кількість теплоти, необхідна для плавлення 1кг льоду або суміші, називається їхньою питомою теплотою плавлення – qпл, кДж/кг. Із зменшенням температури плавлення tпл компонентів розчину, зменшується і питома теплота плавлення. На практиці для охолодження застосовується лід з евтектичних розчинів, нижча температура tпл якого визначається евтектичною точкою. Так, водяні розчини тіосульфіта натрію Nа3S2О3 і нітрати натрію NaNO3 мають температуру замерзання ts відповідно -11ºС і -18,5ºС. Низькі температури можна одержати при змішуванні льоду з розведеними кислотами. Наприклад, суміш із рівних кількостей 66% сірчаної кислоти H2S04 і снігу або подрібненого льоду має ts=-37ºС. При зменшенні концентрації кислоти температура замерзання розчину підвищується.
Кипіння. Процес пароутворення протікає при підведенні теплоти до рідкого тіла. Кількість теплоти, необхідна для перетворення 1кг насиченої рідини в суху насичену пару, називається питомою теплотою пароутворення - r, кДж/кг. Для охолодження випаровуванням застосовують рідини, що мають за атмосферного тиску низьку температуру кипіння і велику теплоту пароутворення. Наприклад, аміак за атмосферного тиску кипить при температурі -33,2 ºС, фреон R12 – -30 ºС.
Процес кипіння речовин широко застосовується при штучному охолодженні в циклах парових, пароежекторних та абсорбційних холодильних машин.
Сублімація. Процес переходу тіл із твердого стану в пароподібний, минаючи проміжний рідкий, називається сублімацією. Найбільш широкого використовується сублімація твердого двоокису вуглецю (“сухий лід”), температура сублімації якого при атмосферному тиску становить -78,9ºС, теплота сублімації – 574 кДж/кг. Зменшуючи тиск до вакууму, можна понизити температуру сублімації “сухого льоду” до -100 ºС.
