
- •2. Дегидроциклизация — образование арена с выделением водорода:
- •3.Гидрирование.
- •4.Реакция замещения
- •1. Образование глюкозы.
- •1. Образование глюкозы.
- •3. Взаимодействие с уксусной кислотой.
- •4. Пенообразование
- •5.Гидратация
- •6.Горение
- •1) В результате реакции выпадает осадок:
- •2) В результате реакции выделяется газ:
- •3) В результате реакции образуется малодиссоциирующее вещество:
1. Образование глюкозы.
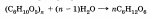
В пищеварительном тракте животных крахмал подвергается сложному ступенчатому гидролизу:
крахмал — декстрины — мальтоза — глюкоза
2. Образование сложных эфиров. Крахмал может образовывать эфиры за счет гидроксигрупп, однако эти эфиры не нашли практического применения.
3. Крахмал взаимодействует с йодом, дает синее окрашивание.
Применение: получение патоки, подкрахмаливание белья, приготовление киселей, производство этанола, выпечка кондитерских изделий.
12. Целлюлоза выделенная из природных материалов (например, вата или фильтровальная бумага), представляет собой твердое волокнистое вещество, нерастворимое в воде. Полисахарид имеет растительное происхождение, выполняет в клетке растений строительную, конструкционную функцию. Поэтому целлюлоза является обязательным элементом клеточной оболочки растений. Волокна хлопка содержат до 95% целлюлозы, волокна льна и конопли — до 80%,вдревесине ее содержится около 50%. Состав можно выразить формулой .
сотен до нескольких тысяч. Целлюлоза отличается большим числом звеньев и, следовательно, молекулярной массой, которая достигает нескольких миллионов.
Целлюлоза — остатки -глюкозы, ориентированные в природные волокна:
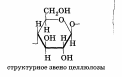
Химические свойства
1. Образование глюкозы.
2. Образование сложных эфиров. За счет этих спиртовых гидроксигрупп целлюлоза и может образовывать сложные эфиры, которые широко применяются.
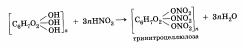
3. Взаимодействие с уксусной кислотой.

Применение: (вата, марли, бинты) медицина, пластмассы, фотопленка, искусственные волокна и ткани, клей, порох, эмали, лаки, бумага.
13.
Аминокислоты. Аминокислоты — это органические бифункциональные соединения, в состав которых входят карбоксильная группа —СООН и аминогруппа —NH2.
Важнейшие a -аминокислоты общей формулы
Аминокислоты не изменяют окраску индикатора, если количество аминогрупп и карбоксильных групп одинаково. Химические свойства
NH2-CH2-COOH + НCl → NH3Cl-CH2-COOH
NH2-CH2-COOH + NaOH → NH2-CH2-COONa + H2O
2NH2-CH2-COOH + MgO → (NH2-CH2-COO)2 Mg + H2O
2NH2-CH2-COOH + Mg → (NH2-CH2-COO)2 Mg + H2
NH2-CH2-COOH + CH3OH → NH2-CH2-COO CH3 + H2O
NH2-CH2-COOH + NH3 → NH2-CH2-COO NH4
NH2-CH2-COOH + NH2-CH2-COOH → NH2-CH2-CO NH-CH2-COOH + H2O
Физические свойства. Аминокислоты представляют собой твердые кристаллические вещества, хорошо растворимые в воде и мало растворимые в органических растворителях. Многие аминокислоты имеют сладкий вкус. Они плавятся при высоких температурах и обычно при этом разлагаются. В парообразное состояние переходить не могут.
Качественные реакции на аминокислоты. 1) Все аминокислоты окисляются нингидрином с образованием продуктов, окрашенных в сине-фиолетовый цвет. Эта реакция может быть использована для количественного определения аминокислот спектрофотометрическим методом. 2) При нагревании ароматических аминокислот с концентрированной азотной кислотой происходит нитрование бензольного кольца и образуются соединения, окрашенные в желтый цвет. Эта реакция называетсяксантопротеиновой (от греч. ксантос — желтый).
14.
Белки. Белки — это природные полипептиды с высокими значениями молекулярной массы (от 10 000 до десятков миллионов). Они входят в состав всех живых организмов и выполняют разнообразные биологические функции.
Белки выполняют разнообразные биологические функции:
каталитические (ферменты), регуляторные (гормоны), структурные (коллаген, фиброин), двигательные (миозин), транспортные (гемоглобин, миоглобин), защитные (иммуноглобулины, интерферон), запасные (казеин, альбумин, глиадин) и другие. Среди белков встречаются антибиотики и вещества, оказывающие токсическое действие.
Строение. Можно выделить четыре уровня в строении полипептидной цепи.
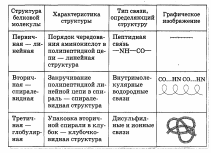
Третичная структура — высшая форма пространственной организации белков. Однако некоторые белки (например, гемоглобин) имеют четвертичную структуру, которая образуется за счет взаимодействия между разными полипептидными цепями.
Физические свойства Белки — амфотерные электролиты. При определенном значении рН среды (она называется изоэлектрической точкой) число положительных и отрицательных зарядов в молекул белка одинаково. Это одно из основных свойств белка. Белки в этой точке электронейтральны, а их растворимость в воде наименьшая. Способность белков снижать растворимость при достижении электронейтральности их молекул используется для выделения их из растворов, например, в технологии получения белковых продуктов.
Химические свойства. 1. Разрушение вторичной и третичной структуры белка с сохранением первичной структуры называют денатурацией. Она происходит при нагревании, изменении кислотности среды, действии излучения. Пример денатурации — свертывание яичных белков при варке яиц. Денатурация бывает обратимой и необратимой. Необратимая денатурация может быть вызвана образованием нерастворимых веществ при действии на белки солей тяжелых металлов — свинца или ртути.
2. Гидролиз белков — это необратимое разрушение первичной структуры в кислом или щелочном растворе с образованием аминокислот.Анализируя продукты гидролиза, можно установить количественный состав белков.
3. Для белков известно несколько качественных реакции (цветные реакции). Все соединения, содержащие пептидную связь, дают фиолетовое окрашивание при действии на них солей меди (II) в щелочном растворе. Эта реакция называется биуретовой. Белки, содержащие остатки ароматических аминокислот (фенилаланина, тирозина), дают желтое окрашивание при действии концентрированной азотной кислоты (ксантопротеиновая реакция).
