
- •2. Дегидроциклизация — образование арена с выделением водорода:
- •3.Гидрирование.
- •4.Реакция замещения
- •1. Образование глюкозы.
- •1. Образование глюкозы.
- •3. Взаимодействие с уксусной кислотой.
- •4. Пенообразование
- •5.Гидратация
- •6.Горение
- •1) В результате реакции выпадает осадок:
- •2) В результате реакции выделяется газ:
- •3) В результате реакции образуется малодиссоциирующее вещество:
По происхождению химические вещества делятся на: а) неорганические (пр. 500 тыс.); б)Органические ( пр. 18 000 000). Органические вещества – это соединения углерода. Классификация органических веществ: С,Н – углеводороды ( алканы, алкены, алкины, алкодиены, арены, циклоалканы); С,Н,О – кислородосодержащие вещества (спирты, альдегиды, карбоновые кислоты, простые эфиры, сложные эфиры, углеводы); С,Н,О,N – азотосодержащие органические вещества ( амины, аминокислоты, белки, нуклеиновые кислоты, гетероциклические соединения).
Органическая химия – это раздел химии, изучающий соединения углерода, их свойства и превращения. Теория химического строения органических соединений Бутлеровым была выдвинута в 1861 году.
Основные положения ТХС:
1. Атомы в молекулах соединены друг с другом в определенной последовательности согласно их валентностям. Последовательность межатомных связей в молекуле называется ее химическим строением и отражается одной структурной формулой (формулой строения). Атомы способны образовывать линейные цепи, разветвленные цепи, замкнутые.
2. Свойства веществ зависят от их химического строения.
3. Атомы и группы атомов в молекуле оказывают взаимное влияние друг на друга.
А) Влияние радикалфенила на гидроксогруппу приводит к усилению поляризации связи в гидроксильной группе, поэтому атом водорода легко замещается на металл и вещество проявляет слабые кислотные свойства.
Б) Влияние гидроксогруппы на радикалфенил приводит к поляризации связи СН в положении 2, 4, 6, поэтому фенол легко вступает в реакцию замещения и атом водорода в бензольном ядре в положении 2, 4, 6 замещается на галоген или гидроксогруппу.
4. По свойствам данного вещества можно определить строение его молекулы, а по строению молекулы - предвидеть свойства.
Алка́ны –это предельные углеводороды с общей формулой CnH2n+2., в молекуле которых все атомы находятся в состоянии sp3-гибридизации и образуют одинарные сигмосвязи. Гомологический ряд – это ряд веществ одного класса, отличающихся друг от друга на гомологическую разность (СН2)n .
-
Гомологический ряд алканов (первые 10 членов)
Метан
CH4
CH4
Этан
CH3—CH3
C2H6
Пропан
CH3—CH2—CH3
C3H8
Бутан
CH3—CH2—CH2—CH3
C4H10
Пентан
CH3—CH2—CH2—CH2—CH3
C5H12
Гексан
CH3—CH2—CH2—CH2—CH2—CH3
C6H14
Гептан
CH3—CH2—CH2—CH2—CH2—CH2—CH3
C7H16
Октан
CH3—CH2—CH2—CH2—CH2—CH2—CH2—CH3
C8H18
Нонан
CH3—CH2—CH2—CH2—CH2—CH2—CH2—CH2—CH3
C9H20
Декан
CH3—CH2—CH2—CH2—CH2—CH2—CH2—CH2—CH2—CH3
C10H22
Физические свойства: имеют три агрегатных состояния ( газы, жидкости, твердые вещества); При нормальных условиях неразветвлённые алканы с CH4 до C4H10 — газы; с C5H12 до C13H28 — жидкости; после C14H30 — твёрдые вещества.
Алканы есть в природе: природный газ, нефть.
Особенности строения: а) атомы углерода образуют линейные и разветвленные цепи; б)угол связи 109028м.Тип связи – сигма.
Химические свойства:
Горение
CH4 + 2O2 → CO2 + 2H2O .
Термическое разложение
Реакции разложения происходят лишь под влиянием больших температур. Повышение температуры приводит к разрыву углеродной связи и образованию свободных радикалов.
Примеры:
2CH4 → C2Н2 + 3H2 (t -1500 °C).
CH4 → C + 2H2 (t -500 °C).
2CH4 → C2Н4 + 2H2 (t - 1000 °C).
Замещение – реакция хлорирования, идет ступенчато по радикальному механизму. CH4 + Cl2 → HCl + CH3Cl (хлорметан)
CH3Cl + Cl2 → HCl + CH2Cl2 (дихлорметан)
CH2Cl2 + Cl2 → HCl + CHCl3 (трихлорметан)
CHCl3 + Cl2 → HCl + CCl4 (тетрахлорметан).
Дегидрирование – отщепление водорода.
а)CH3-CH3 → CH2=CH2 + H2 (этан → этен); условия Ni, t;
б)CH3-CH2-CH3 → CH2=CH-CH3 + H2 (пропан → пропен); условия Ni, t.
Мета́н — простейший углеводород, бесцветный газ (в нормальных условиях) без запаха, химическая формула — CH4. Малорастворим в воде, легче воздуха. Применение метана
Топливо.
Продукты хлорирования используются в огнетушителях, а также как снотворное, или растворитель.
Производство продукта дегидрирования-ацетилена.
Продукт конверсии-синтез-газ. Используется для производства метанола и формальдегида, а следовательно и полимеров, медикаментов и денатурирующих и дезинфицирующих материалов. Также из синтез-газа изготавливаются аммиак и удобрения.
Алке́ны — ациклические непредельные углеводороды, содержащие одну двойную связь между атомами углерода, образующие гомологический ряд с общей формулой CnH2n. Атомы углерода при двойной связи находятся в состоянии sp² гибридизации, и имеют валентный угол 120°.
-
этен (этилен)
C2H4
пропен
C3H6
бутен
C4H8
пентен
C5H10
гексен
C6H12
гептен
C7H14
октен
C8H16
нонен
C9H18
децен
C10H20
Для алкенов характерны изомерии углеводородной цепи, положения двойной связи, межклассовая и стереоизомерия. Например, единственным изомером пропена является циклопропан (C3H6) по межклассовой изомерии. Начиная с бутена, существуют изомеры по положению двойной связи (бутен-1 и бутен-2), по углеродному скелету (изобутилен или метилпропен) и стереоизомеры (цис-бутен-2 и транс-бутен-2). .
Стереоизомерия показывает различное положение заместителей по отношению плоскости двойной связи:
цис- изомеры: заместители расположены по одну сторону от двойной связи;
транс- изомеры: заместители расположены по разные стороны от двойной связи.
Химические свойства:
Горение: C2H4+3О2=2СО2+Н2О
Гидрирование: С2Н4+Н2=С2Н6 (условия t, Ni).
Галогенирование – присоединение галогенов: С2Н4+Br2= С2Н4Br2
Гидротация – присоединение воды: С2Н4+Н2О=С2Н5ОН
Гидрогалогенирование – присоединение галогенов водорода. Реакция протекает по правилу Морковникова: Н присоединяется к более гидрировнному атому углерода, а галоген к менее гидрированному.
СН2=СН2-СН3+НF→СН3-СНF-СН3
Реакция
полимеризации
– получение полимеров из мономеров
путем последовательных реакций
присоединения:
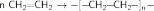
Алкены окисляются под действием KMnO4 :
Алкены являются важнейшим химическим сырьем. Этилен используется для производства различных химических соединений. Полимеризацией этилена и его прямых производных получают полиэтилен, поливинилацетат, поливинилхлорид, каучуки и смазочные масла.
Арены – ароматические УВ с общей формулой CnH2n-6, в молекулах которых есть бензольное ядро. Важнейшие представители: С6Н6 (бензол), С7Н8 (толуол), С8Н10 (этилбензол).
Бензол С6Н6:
По современным представлениям все шесть атомов углерода в молекуле бензола находятся в sp2-гибридном состоянии. Каждый атом углерода образует s -связи с двумя другими атомами углерода и одним атомом водорода, лежащие в одной плоскости. Валентные углы между тремя s -связями равны 120°. Таким образом, все шесть атомов углерода лежат в одной плоскости, образуя правильный шестиугольник.
Структурная изомерия в гомологическом ряду бензола обусловлена взаимным расположением заместителей в ядре. Монозамещенные производные бензола не имеют изомеров положения, так как все атомы в бензольном ядре равноценны. Дизамещенные производные существуют в виде трех изомеров,
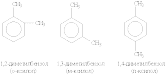
различающихся взаимным расположением заместителей. Положение заместителей указывают цифрами или приставками: орто- (о-), мета- (м-), пара- (п-).
Физические свойства. Первые члены гомологического ряда бензола (например, толуол, этилбензол и др.) — бесцветные жидкости со специфическим запахом. Они легче воды и нерастворимы в ней. Хорошо растворяются в органических растворителях. Бензол и его гомологи сами являются хорошими растворителями для многих органических веществ. Все арены горят коптящим пламенем ввиду высокого содержания углерода в их молекулах.
Химические свойства бензола.
Реакции замещения: 1. Галогенирование. Бензол не взаимодействует с хлором или бромом в обычных условиях. Реакция может протекать только в присутствии катализаторов — безводных АlСl3, FeСl3, АlВr3. В результате реакции образуются галогенозамещенные арены:
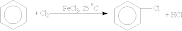
2. Нитрование.
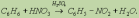
Реакции присоединения:
1.Гидрирование. С6Н6+3Н2=С6Н12
2.Галогенирование. С6Н6+3Сl2=С6Н6Cl6
Реакция горения: 2С6Н6+15О2=12СО2+6Н2О
Получение бензола:
1. Дегидрирование циклоалканов. Реакция происходит при пропускании паров циклогексана и его гомологов над нагретой платиной:
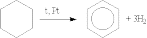
2. Дегидроциклизация — образование арена с выделением водорода:

3. Получение бензола тримеризацией ацетилена. 3С2Н2 → С6H6
Ввести углеводородный заместитель в ароматическое кольцо можно несколькими способами:
4. Синтез Вюрца: C6H5Br + 2Na + ВrC4H9 -> С6Н5 — С4Н9+ 2NaВr
5. Алкилирование алканами: С6H6 + С2H5Cl -(AlCl3)→ С6H5С2H5 + HCl
Бензол широко применяется в промышленности, является исходным сырьём для производства полимеров (пластиков, резины), лекарств, красителей, пестицидов, моющих средств, взрывчатых веществ. Используется как растворитель для лаков. Бензол - один из наиболее распространенных химических продуктов. Бензол - самое распространенное ароматическое соединение. В физическом весе пластмасс 32%, в каучуках и резинах - 66%, в синтетических волокнах - до 82% приходится на производные бензола.
Основными природными источниками углеводородов являются нефть, природный и попутный нефтяной газы и каменный уголь. Природный газ. Природный газ – смесь газов, основным компонентом которой является метан, остальное приходится на долю этана, пропана, Бутана, и небольшого количества примесей – азота, оксида углерода (IV), сероводорода и паров воды. 90% его расходуется в качестве топлива, остальные 10% используют как сырье для химической промышленности: получение водорода, этилена, ацетилена, сажи, различный пластмасс, медикаментов и др., в нем присутствуют те же примеси, что и в природном газе. Нефть. Нефть – маслянистая жидкость от желтого или светло-бурого до черного цвета с характерным запахом. Она легче воды и в ней практически нерастворима. Нефть представляет собой смесь примерно 150 углеводородов с примесями других веществ, поэтому у нее нет определенной температуры кипения. 90% добываемой нефти используется как сырье для производства различных видов топлива и смазочных материалов. В то же время нефть – ценное сырье для химической промышленности. Нефть, добываемую из земных недр, называю сырой. В сыром виде нефть не применяют, ее подвергают переработке. Сырую нефть очищают от газов, воды и механических примесей, а затем подвергают фракционной перегонке. Перегонка – процесс разделения смесей на отдельные компоненты, или фракции, на основании различия их температур кипения. При перегонке нефти выделяют несколько фракций нефтепродуктов: Газовая фракция (tкип = 40°С) содержит нормальные и разветвленные алканы СН4 – С4Н10; Бензиновая фракция (tкип = 40 - 200°С) содержит углеводороды С5Н12 – С11Н24; при повторной перегонке из смеси выделяют легкие нефтепродукты, кипящие в более низких интервалах температур: петролейный эфир, авиационный и автомобильный бензин; Лигроиновая фракция (тяжелый бензин, tкип = 150 - 250°С), содеожит углеводороды состава С8Н18 – С14Н30, применяют в качестве горючего для тракторов, тепловозов, грузовых автомобилей; Керосиновая фракция (tкип = 180 - 300°С) включает углеводороды состава С12Н26 - С18Н38; ее используют в качестве горючего для реактивных самолетов, ракет; Газойль (tкип = 270 - 350°С) используют как дизельное топливо и в больших масштабах подвергается крекингу. После отгонки фракций остается темная вязкая жидкость – мазут. Из мазута выделяют соляровые масла, вазелин, парафин. Остаток от перегонки мазута – гудрон, его применяют при производстве материалов для дорожного строительства. Вторичная переработка нефти основана на химических процессах. Крекинг – расщепление крупных молекул углеводородов на более мелкие. Различают термический и каталитический крекинг, который более распространен в настоящее время. Нефть – сырье для производства не только топлива, но и многих органических веществ. Каменный уголь. Каменный уголь так же является источником энергии и ценным химическим сырьем. В состав каменного угля в основном органические вещества, а также вода, минеральные вещества, при сжигании образующие золу. Одним из видов переработки каменного угля является коксование – это процесс нагревания угля до температуры 1000°С без доступа воздуха. Коксование угля проводят в коксовых печах. Кокс состоит из практически чистого углерода. Его используют в качестве восстановителя при доменом производстве чугуна на металлургических заводах. Летучие вещества при конденсации каменноугльную смолу (содержит много различных органических веществ, из них большая часть – ароматические), аммиачную воду (содержит аммиак, соли аммония) и коксовый газ (содержит аммиак, бензол, водород, метан, оксид углерода (II), этилен, азот и другие вещества).
Спиртами называют соединения, содержащие одну или несколько гидроксильных групп (ОН), непосредственно связанных с углеводородным радикалом. Спирты делятся на предельные ( радикал от алкана), непредельные (радикал содержит двойную или тройную связь), ароматические(радикал содержит бензольное ядро). В зависимости от числа гидроксильных групп спирты подразделяют на одно-, двух- и трехатомные. Двухатомные спирты часто называют гликолями. Спирты, содержащие несколько групп —ОН, объединяют общим названием многоатомные спирты. Предельные одноатомные спирты – это производные алканов, в молекуле которых один атом водорода замещен на гидроксогруппу. Общая формула предельных одноатомных спиртов СnH2n+1OH.
Химическая формула спирта |
Название по номенклатуре ИЮПАК |
Тривиальное название |
Предельные одноатомные спирты |
||
CH3OH |
Метанол |
Древесный спирт |
C2H5OH |
Этанол |
Винный спирт |
C5H11OH |
Пентанол |
Амиловый спирт |
C16H33OH |
Гексадеканол |
Цетиловый спирт |
Физические свойства: Предельные одноатомные спирты от C1 до C12 — жидкости. Высшие спирты — мазеобразные вещества, от C21и выше — твердые вещества. Все спирты легче воды (плотность ниже единицы). Спирты имеют высокую температуру кипения.
Химические свойства:
Горение: C2H6OH + 3О2=2СО2+3Н2О
Каталитическое окисление:
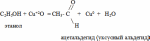
Дегидратация – отщепление воды:
1)внутримолекулярная
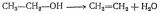
2) межмолекулярная
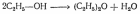
Взаимодействие со щелочными металлами: 2C2H5OH + 2Na = 2C2H5ONa + H2
Взаимодействие с галогенами водорода: C2H5OH + HCl = C2H5Cl + H2O
Этерификация – реакция с кислотами с образованием сложных эфиров:
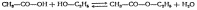
(условие Н2SO4)
Получение спиртов:
1.
При реакции
галогеналканов со щёлочью:
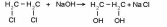
2. Гидратация алкенов: С2Н4+Н2О=С2Н5ОН (условие Н+)
3. Гидрирование альдегидов и кетонов:
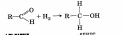
4. Окисление алкенов.
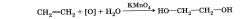
5. Брожение глюкозы.
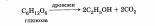
Применение метилового спирта: Метиловый спирт широко используется в промышленности для синтеза формальдегида, полимерных материалов. Применяют его в качестве растворителей для лаков, политур, красителей. Из метилового спирта получают различные органические продукты, в том числе — высокооктановое топливо. Спирт используют в органическом синтезе как метилирующий агент (средство для введения в органические соединения группы СН3). Метиловый спирт — сильный яд. Несколько его граммов, попав в организм, приводят к слепоте, а большие количества — к смерти. Поэтому метиловый спирт для технических нужд идет под обязательным названием "Метанол — яд" и хранится в специальных опечатанных хранилищах (сейфах).
7.
Альдегиды – это органические вещества, молекулы которых содержат карбонильную группу, которая связана по крайней мере с одним атомом водорода и углеводородным радикалом.
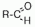
Физические свойства: Альдегиды — полярные вещества с избыточной электронной плотностью на атоме кислорода. Низшие члены ряда альдегидов (формальдегид, уксусный альдегид,)растворимы в воде неограниченно. Их температуры кипения ниже, чем у соответствующих спиртов .Низшие альдегиды имеют резкий запах, у альдегидов, содержащих от четырех до шести атомов углерода в цепи, неприятный запах,высшие альдегиды и кетоны обладают цветбчньщи запахами и применяются в парфюмерии.
Способы получения. Исходными соединениями для получения альдегидов и кетонов могут быть углеводороды, галогенопроизводные, спирты или кислоты.
1. Гидратация алкинов ( реакция Кучерова). Взаимодействие алкинов с водой происходит в присутствии солей Нg2+.
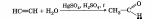
2. Дегидрирование спиртов.
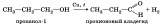
Химические свойства.
для альдегидов и кетонов характерны реакции присоединения по двойной связи С=О. Большинство из них протекает как нуклеофильное присоединение.
1.Реакции нуклеофильного присоединения. Альдегиды и кетоны, обладая электрофильным центром, способны вступать во взаимодействие с нуклеофильными реагентами.
2. Реакции окисления. . Альдегиды легко (значительно легче, чем спирты) окисляются в соответствующие карбоновые кислоты. Для их окисления можно использовать такие мягкие окислители, как оксид серебра и гидроксид меди (II).
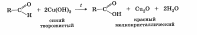
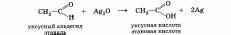
Реакция с оксидом серебра называется реакцией «серебряного зеркала».
