
- •1 .Орташа арифметикалық жылдамдығын, орташа квадраттық жылдамдығын және ең ықтимал жылдамдықтарды анықтайтын өрнектерін салыстырып, осы есептелген үш жылдамдықтар арасындағы байланысты талдаңыз.
- •1.Бірінші текті фазалық ауысулар.Фазалық тепе-теңдік сызығы.Клапейрон- Клаузиус теңдеуі
- •3. Идеал газ күйінің теңдеуі, оның жалпы анықталмаған түрі. Қысымның газдың сандық тығыздығымен байланысы.
- •2.Максвеллдің үлестірілу функциясының жылдамдықтың х –компоненті үшін түрі.
- •3.Жылу молшері. Жылу мөлшерінің процеске катысты анықталуы.
- •1. Изобарлық процестегі жылусыйымдылық. Майер теңдеуі.
- •1.Изохоралық процесс.
- •2. Идеал газдардың жылу сыйымдылығы.
- •3. Заттың құрылымдық элементтері. Зат молшері – моль.
- •2. Температура түсініктемесі. Температуралық шкала, реперлік нүктелер, температураны
- •3.Термодинамиканың 2 бастамасы жане оның физикалық мағынасы.
- •3.Еркіндік дәрежелер саны. Газдардың жылусыйымдылығы арасындағы қатынастар
- •3.Энергияның тең үлестірілу заңы.
- •2. Термодинамиканың екінші бастамасының статистикалық сипаты. Энтропияның физикалық мағынасы
- •3.Материялық денелердің молекула-кинетикалық моделі. Атомдар мен молекулалар массасы.
- •1. Зат қасиеттерінің құрылымы мен моле-дың жылулық қозғалыспен байланысы.
- •1. Карно циклі. Карно циклінің пайдалы әсер коэффициенті. Карно теоремасы.
- •3. Молекулааралық өзара әрекеттесу күштері. Алыстан және жақыннан әсерлесу күштері. Күштердің молекулааралық қашықтыққа тәуелділігі.
- •1.Сиретілген газдардағы физикалық құбылыстар
- •3.Молекулааралық өзара әрекеттесу күштері.Күштердің молекулааралық қашықтыққа тәуелділігі.
- •2.Газдардағы еркін жүру жолы мен орташа соқтығысу саны
- •3.Адиабаталық процесстегі жұмыстың формуласы
- •1. Концентрация. Көлемдік, салыстырмалы мольдік, салыстырмалы массалық концентрация.Парциал қысым және оның қоспадағы мольдік үлесімен байланысы. Дальтон заңы
- •3.Идеал газдың ішкі энергиясы. Ішкі энергияның жүйенің күйіне тәуелділігі.
- •1. Адиабаттық процесс. Пуассон теңдеуі.
- •2. Жылудың механикалық жұмысқа айналуы. Циклдік процестер. Цикл жұмысы.
- •3. Жылуөткізгіштік. Фурье заңы. Жылуөткізгіштік коэффициентінің қысым мен температураға тәуелділігі.
- •2.Политроптық процесс.Политроп теңдеуі.
- •1. Политроптық процесс.Политроп теңдеуі.
- •2.Изотермдік процесс.Изотермдік процесс кезіндегі жұмыстың формуласы.
- •3.Тұтқырлық. Ньютонның үйкеліс заңы. Тұтқырлық коэффициентінің қысым мен температураға тәуелділігі.
- •1.Изохоралық процесс.
- •3.Ньютонның үйкеліс заңы. Тұтқырлық коэффициентінің қысым мен температураға тәуелділігі.
3. Заттың құрылымдық элементтері. Зат молшері – моль.
Заттың мөлшерін денедегі молекулалар немесе атомдар санымен өлшеген әлдеқайда табиғи болған болар еді. Алайда кез келген макроскопиялық денедегі молекулалар саны орасан көп, сондықтан есептеулерде молекулалардың абсолюттік емес, салыстырмалы санын пайдаланылады.
Халқаралық біріліктер жұйесінде заттың мөлшері мольмен өрнектеледі. Бір моль – бұл массасы 0,012 кг көміртегінде қанша атом болса, молекуласы немесе атомы бар заттың мөлшері.
Демек,
кез келген заттың 1 мөліндегі атомдар
немесе молекулалар саны бәрінде бірдей.
Бұл атомдар санын NА деп
белгілейді және оны итальян ғалымы (ХІХ
ғасыр) құрметіне Авогадро
тұрақтысы деп
атайды. Авогадро
тұрактысын анықтау үшін көміртегінің
бір атомының массасын
табу керек. Массаны нобайлап өлшеуді,
жоғарыда су
молекуласы массасын калай өлшеген
болсак, нақ, солай жасауға
болады. (ал массаны өлшеудің өте дәлірек
әдісі электромагнит
өрісінің иондар шоғын бұруына
негізделген).
Өлшеулер
кеміртегі атомының
массасы: тос= 1,995-1026 кг екендігін
көрсетеді.
Авогадро
тұрақтысы NА -ны
бір моль мөлшерінде алынған
көміртегі массасын
бір атом көміртеі массасына бөліп
анықтауға болады:NА= 0.012
 .
. == 0.012
.
== 0.012
. =6.02
=6.02
Моль-1 атауы бір моль мөлшерінде алынған кез келген заттың атомдар санын (NА) көрсетеді. Егер заттың мөлшері v= 2,5 моль болса, онда сол денедегі молекулалар саныNА = v/ NА = 1,5-1024. Сонымен , заттың, мөлшері v берілген денедегі Nмолекулалар санының NА Авогадро тұрақтысына, яғни заттың 1 моліндегі молекулалар санының катынасына тең: Авогадро тұрақтысы шамасы аса зор макроскопиялықпен са-лыстырранда микроскопиялық масштабтардың каншалықты кішкентай екенін көрсетеді. Заттың, мөлшері 1 моль дененің өзіміз үйреншікті макроскопиялық өлшемдері және бірнеше, ондаған грамм шамасында массасы болады.
№6 билет
1.Гей-Люссак
заңы.
Бұл заңды 1802 ж. ашқан Ж.Л.Гей-Люссак және
1801ж. оған тәуелсіз Дж. Дальтон ұсынған.
Гей-Люссак заңы тұрақты қысымда идеал
газдың көлемі температура бойынша
сызықты өзгереді дейді:
 ,мұндағы
,мұндағы
 – газдың алғашқы көлемі;
– газдың алғашқы көлемі;
 – газдың бастапқы және соңғы
температураларының айырмасы;
– газдың бастапқы және соңғы
температураларының айырмасы;
 – газдың жылулық
немесе көлемдік
ұлғаю
коэффициенті.Идеал
газ күйінің (2.55)-ші теңдеуі, қысым тұрақты
болғанда, былай жазылады:
– газдың жылулық
немесе көлемдік
ұлғаю
коэффициенті.Идеал
газ күйінің (2.55)-ші теңдеуі, қысым тұрақты
болғанда, былай жазылады:
 немесе
немесе
 .Осы
теңдеу изобар
теңдеуі
деп аталады, ал тұрақты қысымда өтетін
процесті изобарлық
процесс
дейді. (2.61)-ші формула Гей-Люссак
заңын
анықтайы.
.Осы
теңдеу изобар
теңдеуі
деп аталады, ал тұрақты қысымда өтетін
процесті изобарлық
процесс
дейді. (2.61)-ші формула Гей-Люссак
заңын
анықтайы.
Б
ұл
заңды кейбірде Шарль заңы деп атауы
дұрыс емес. Әр түрлі қысым-дар үшін
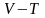 – диаграммасында
– диаграммасында
 көлемнің температураға тәуелділік
графигі 2.6-суретте көрсе-тілген. Идеал
газ изобарлары
– диаграммасында координаттар осте-рінің
басынан шығатын, бұрыштық коэффициенті
көлемнің температураға тәуелділік
графигі 2.6-суретте көрсе-тілген. Идеал
газ изобарлары
– диаграммасында координаттар осте-рінің
басынан шығатын, бұрыштық коэффициенті
 -ға
тең түзу сызықтар. (2.61)-шы теңдеудегі
коэффицентін (2.57) формула бойын-ша
анықтаймыз:
-ға
тең түзу сызықтар. (2.61)-шы теңдеудегі
коэффицентін (2.57) формула бойын-ша
анықтаймыз:
 ,
осыдан
,
осыдан
 (2.62)
(2.62)
Идеал
газдың көлемдік ұлғаю коэффициенті
абсолюттік температура шамасына
кері пропорционал болады. Мысалы,
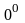 С-де
С-де
 К-1,
барлық газдарға бірдей.
К-1,
барлық газдарға бірдей.
