
- •1 .Орташа арифметикалық жылдамдығын, орташа квадраттық жылдамдығын және ең ықтимал жылдамдықтарды анықтайтын өрнектерін салыстырып, осы есептелген үш жылдамдықтар арасындағы байланысты талдаңыз.
- •1.Бірінші текті фазалық ауысулар.Фазалық тепе-теңдік сызығы.Клапейрон- Клаузиус теңдеуі
- •3. Идеал газ күйінің теңдеуі, оның жалпы анықталмаған түрі. Қысымның газдың сандық тығыздығымен байланысы.
- •2.Максвеллдің үлестірілу функциясының жылдамдықтың х –компоненті үшін түрі.
- •3.Жылу молшері. Жылу мөлшерінің процеске катысты анықталуы.
- •1. Изобарлық процестегі жылусыйымдылық. Майер теңдеуі.
- •1.Изохоралық процесс.
- •2. Идеал газдардың жылу сыйымдылығы.
- •3. Заттың құрылымдық элементтері. Зат молшері – моль.
- •2. Температура түсініктемесі. Температуралық шкала, реперлік нүктелер, температураны
- •3.Термодинамиканың 2 бастамасы жане оның физикалық мағынасы.
- •3.Еркіндік дәрежелер саны. Газдардың жылусыйымдылығы арасындағы қатынастар
- •3.Энергияның тең үлестірілу заңы.
- •2. Термодинамиканың екінші бастамасының статистикалық сипаты. Энтропияның физикалық мағынасы
- •3.Материялық денелердің молекула-кинетикалық моделі. Атомдар мен молекулалар массасы.
- •1. Зат қасиеттерінің құрылымы мен моле-дың жылулық қозғалыспен байланысы.
- •1. Карно циклі. Карно циклінің пайдалы әсер коэффициенті. Карно теоремасы.
- •3. Молекулааралық өзара әрекеттесу күштері. Алыстан және жақыннан әсерлесу күштері. Күштердің молекулааралық қашықтыққа тәуелділігі.
- •1.Сиретілген газдардағы физикалық құбылыстар
- •3.Молекулааралық өзара әрекеттесу күштері.Күштердің молекулааралық қашықтыққа тәуелділігі.
- •2.Газдардағы еркін жүру жолы мен орташа соқтығысу саны
- •3.Адиабаталық процесстегі жұмыстың формуласы
- •1. Концентрация. Көлемдік, салыстырмалы мольдік, салыстырмалы массалық концентрация.Парциал қысым және оның қоспадағы мольдік үлесімен байланысы. Дальтон заңы
- •3.Идеал газдың ішкі энергиясы. Ішкі энергияның жүйенің күйіне тәуелділігі.
- •1. Адиабаттық процесс. Пуассон теңдеуі.
- •2. Жылудың механикалық жұмысқа айналуы. Циклдік процестер. Цикл жұмысы.
- •3. Жылуөткізгіштік. Фурье заңы. Жылуөткізгіштік коэффициентінің қысым мен температураға тәуелділігі.
- •2.Политроптық процесс.Политроп теңдеуі.
- •1. Политроптық процесс.Политроп теңдеуі.
- •2.Изотермдік процесс.Изотермдік процесс кезіндегі жұмыстың формуласы.
- •3.Тұтқырлық. Ньютонның үйкеліс заңы. Тұтқырлық коэффициентінің қысым мен температураға тәуелділігі.
- •1.Изохоралық процесс.
- •3.Ньютонның үйкеліс заңы. Тұтқырлық коэффициентінің қысым мен температураға тәуелділігі.
3. Идеал газ күйінің теңдеуі, оның жалпы анықталмаған түрі. Қысымның газдың сандық тығыздығымен байланысы.
Газ
күйін сипаттайтын параметрлер арасында
байланыс болады. Газдың күйін анықтайтын
негізгі параметрлерге газдың
 қысымы,
қысымы,
 температурасы және
температурасы және
![]() көлемі жатады. Бұл параметрлердің
байла-нысын анықтайтын теңдеуді газ
күйінің теңдеуі деп атайды. Оның жалпы
анықталмаған түрі былай жазылады:
көлемі жатады. Бұл параметрлердің
байла-нысын анықтайтын теңдеуді газ
күйінің теңдеуі деп атайды. Оның жалпы
анықталмаған түрі былай жазылады:
![]()
немесе
![]() әрбіреуінің қалған екеуіне тәуелділігін
ескеріп
әрбіреуінің қалған екеуіне тәуелділігін
ескеріп
![]() ,
немесе
,
немесе
![]() деп те жазамыз.
деп те жазамыз.
Қысымды анықтайтын молекула-кинетикалық теңдеуін және температураның анықтамасын қолданып, мына фор-муланы аламыз:
![]()
Егер
газдың массасы өзгермесе,
![]() тұрақты болады, онда p
қысым
тұрақты болады, онда p
қысым
![]() температураға пропорционал.
температураға пропорционал.
Егер газдың қоспасын алсақ, онда массалары әр түрлі газдардың молекулаларының орташа жылдамдықтары әр түрлі, бірақ орташа энергиясы бірдей болады. Қоспаның қысымы мынаған тең болады:
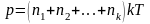 ,
(2.51)
,
(2.51)
мұндағы
 – компоненттің бірлік көлемдегі
молекулалар саны немесе
– компоненттің бірлік көлемдегі
молекулалар саны немесе
 (2.52)
(2.52)
мұндағы -
- – компоненттің парциал қысымы.
– компоненттің парциал қысымы.
(2.52) өрнегі Дальтон заңы деп аталады. Бұл заң идеал газ қоспасының қысымы, сол қоспаны құрайтын компоненттердің парциал қысымдарының қосындысына тең екенін көрсетеді.
Егер
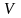 көлемде
көлемде
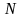 молекула болса, онда
молекула болса, онда
 ,
осыны ескеріп (2.51) теңдеуді былай жазамыз:
,
осыны ескеріп (2.51) теңдеуді былай жазамыз:
 немесе
немесе
 (2.53)
(2.53)
Осы
(2.53) теңдеуге үш негізгі күй параметлері
,
,
кіреді, сондықтан бұны газ күйінің
теңдеуі деп айтуға болады. Бірақ бұл
теңдеуді белгілі зат мөлшері үшін жазу
керек, мысалы, бір моль үшін жазсақ,
онда
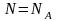 ,
сондықтан
,
сондықтан
 ,
(2.54)
,
(2.54)
мұндағы
 – екі іргелі тұрақтылардың көбейтінідісі
универсал
газ тұрақтысы
деп аталады және R
әрпімен белгіленеді, демек
– екі іргелі тұрақтылардың көбейтінідісі
универсал
газ тұрақтысы
деп аталады және R
әрпімен белгіленеді, демек
 .Оның
мәні
.Оның
мәні
 Дж/мольК.
Дж/мольК.
Универсал газ тұрақтысын ескеріп (2.54)-ші теңдеуді мына түрде жазамыз:
 (2.55)
(2.55)
Осы
өрнек Менделеев-Клапейрон
теңдеуі
немесе бір моль идеал газ күйінің теңдеуі
деп аталады. Ал газдың кез келген m
массасы үшін күй теңдеуі былай анықталады.
(2.53) өрнектегі газдың N
молекулалар санын, мольдің анықтамасын
қолданып, былай жазамыз
 .
Онда (2.53) мына түрде жазылады:
.
Онда (2.53) мына түрде жазылады:
 (2.56)
(2.56)
мұндағы
 – берілген газ массасындағы мольдер
саны. (2.55)-ті ескеріп, (2.57)-ні мына түрде
жазуға болады:
– берілген газ массасындағы мольдер
саны. (2.55)-ті ескеріп, (2.57)-ні мына түрде
жазуға болады:
 немесе
немесе
 (2.57)
(2.57)
Осы (2.57) өрнек идеал газдың кез келген m массасы үшін жазылған күй теңдеуі.
№3билет
1.Қысымның
физикалық мағынасы. Газ қысымының
молекулалардың ілгерілемелі қозғалысының
энергия тығыздығымен анықталатынын
дәлелдеңіз.Қысым
 бетке әсер ететін күштің нормаль
құраушысының
-ке
қатынасы арқылы анықталады, демек
бетке әсер ететін күштің нормаль
құраушысының
-ке
қатынасы арқылы анықталады, демек .
.
Ньютонның
2-ші заңы бойынша
 уақыт аралығында
уақыт аралығында
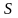 ауданға ОХ
осі бағытта берілетін
ауданға ОХ
осі бағытта берілетін
 импульсті анықтаймыз
импульсті анықтаймыз
 . Сонымен,
уақыт бойынша орташаланған немесе
бірлік уақытта қабырғаға берілетін
импульстің қосындысы мынаған тең болады:
. Сонымен,
уақыт бойынша орташаланған немесе
бірлік уақытта қабырғаға берілетін
импульстің қосындысы мынаған тең болады:

 Қысым
бірлік көлемдегі молекулалардың
ілгерілемелі қозғалысының кинетикалық
энергиясының үштен екісіне тең
Қысым
бірлік көлемдегі молекулалардың
ілгерілемелі қозғалысының кинетикалық
энергиясының үштен екісіне тең
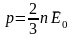 . (1)
. (1)
 (1)
ші теңдеуден
(1)
ші теңдеуден
 тұрақты болғанда, қысым молекуланың
тұрақты болғанда, қысым молекуланың
 ілгерілемелі қозғалысының орташа
кинетикалық энергиясына пропор-ционалдығы
шығады.
ілгерілемелі қозғалысының орташа
кинетикалық энергиясына пропор-ционалдығы
шығады.
 екенін ескеріп, осы теңдеуді былай
жазамыз:
екенін ескеріп, осы теңдеуді былай
жазамыз:
 ,
,
 – газдағы
молекуланың толық энергиясы
– газдағы
молекуланың толық энергиясы
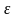 – энергия тығыздығы.
– энергия тығыздығы.
 Газдағы
молекулалар қозғалысын толық сипаттау
үшін, олардың өзі орналасқан ыдыстың
қабырғасымен соқтығысу мәселесін шешу
қажет. Бұл мәселені шешу, біздің алға
қойғалы отырған мақсатымыз, газдың ыдыс
қабырғаларына түсіретін қысымын және
осы қысым сияқты макроскоптық
параметрлердің газдың сипаттамаларымен
байланысын түсіндіру болып табылады.
Газдағы
молекулалар қозғалысын толық сипаттау
үшін, олардың өзі орналасқан ыдыстың
қабырғасымен соқтығысу мәселесін шешу
қажет. Бұл мәселені шешу, біздің алға
қойғалы отырған мақсатымыз, газдың ыдыс
қабырғаларына түсіретін қысымын және
осы қысым сияқты макроскоптық
параметрлердің газдың сипаттамаларымен
байланысын түсіндіру болып табылады.
Біз
идеал
газды қарастырамыз. Онда молекулалық
күштер ескеріл-мейді, газдың молекулалары
материялық нүктелер деп есептеледі.
Мұндай молекулалар уақытының басым
көпшілігін еркін қозғалыста өткізеді,
тек кейде бір-біріне немесе өзі орналасқан
ыдыстың қабырға-ларына серпімді
соқтығысады. Газ тепе-теңдік күйде, онда
барлық
 -молекулалар
жылдамдығы бірдей және декарт координнаттар
жүйе-сінің үш осьтері бойымен 1/6 бөлігі
оң бағытта, ал 1/6 бөлігі кері бағытта
қозғалады, Қозғалыс бағыттарының
ықтималдығы бірдей.
-молекулалар
жылдамдығы бірдей және декарт координнаттар
жүйе-сінің үш осьтері бойымен 1/6 бөлігі
оң бағытта, ал 1/6 бөлігі кері бағытта
қозғалады, Қозғалыс бағыттарының
ықтималдығы бірдей.
Қысым бетке әсер ететін күштің нормаль құраушысының -ке қатынасы арқылы анықталады, демек .Ньютонның 2-ші заңы бойынша уақыт аралығында ауданға ОХ осі бағытта берілетін импульсті анықтаймыз: . Сонымен, уақыт бойынша орташаланған немесе бірлік уақытта қабырғаға берілетін импульстің қосындысы мынаған тең болады:
Қысым бірлік көлемдегі молекулалардың ілгерілемелі қозғалысының кинетикалық энергиясының үштен екісіне тең .(1) (1) ші теңдеуден тұрақты болғанда, қысым молекуланың ілгерілемелі қозғалысының орташа кинетикалық энергиясына пропор-ционалдығы шығады. екенін ескеріп, осы теңдеуді былай жазамыз: ,
– газдағы молекуланың толық энергиясы – энергия тығыздығы.
