- •1 .Орташа арифметикалық жылдамдығын, орташа квадраттық жылдамдығын және ең ықтимал жылдамдықтарды анықтайтын өрнектерін салыстырып, осы есептелген үш жылдамдықтар арасындағы байланысты талдаңыз.
- •1.Бірінші текті фазалық ауысулар.Фазалық тепе-теңдік сызығы.Клапейрон- Клаузиус теңдеуі
- •3. Идеал газ күйінің теңдеуі, оның жалпы анықталмаған түрі. Қысымның газдың сандық тығыздығымен байланысы.
- •2.Максвеллдің үлестірілу функциясының жылдамдықтың х –компоненті үшін түрі.
- •3.Жылу молшері. Жылу мөлшерінің процеске катысты анықталуы.
- •1. Изобарлық процестегі жылусыйымдылық. Майер теңдеуі.
- •1.Изохоралық процесс.
- •2. Идеал газдардың жылу сыйымдылығы.
- •3. Заттың құрылымдық элементтері. Зат молшері – моль.
- •2. Температура түсініктемесі. Температуралық шкала, реперлік нүктелер, температураны
- •3.Термодинамиканың 2 бастамасы жане оның физикалық мағынасы.
- •3.Еркіндік дәрежелер саны. Газдардың жылусыйымдылығы арасындағы қатынастар
- •3.Энергияның тең үлестірілу заңы.
- •2. Термодинамиканың екінші бастамасының статистикалық сипаты. Энтропияның физикалық мағынасы
- •3.Материялық денелердің молекула-кинетикалық моделі. Атомдар мен молекулалар массасы.
- •1. Зат қасиеттерінің құрылымы мен моле-дың жылулық қозғалыспен байланысы.
- •1. Карно циклі. Карно циклінің пайдалы әсер коэффициенті. Карно теоремасы.
- •3. Молекулааралық өзара әрекеттесу күштері. Алыстан және жақыннан әсерлесу күштері. Күштердің молекулааралық қашықтыққа тәуелділігі.
- •1.Сиретілген газдардағы физикалық құбылыстар
- •3.Молекулааралық өзара әрекеттесу күштері.Күштердің молекулааралық қашықтыққа тәуелділігі.
- •2.Газдардағы еркін жүру жолы мен орташа соқтығысу саны
- •3.Адиабаталық процесстегі жұмыстың формуласы
- •1. Концентрация. Көлемдік, салыстырмалы мольдік, салыстырмалы массалық концентрация.Парциал қысым және оның қоспадағы мольдік үлесімен байланысы. Дальтон заңы
- •3.Идеал газдың ішкі энергиясы. Ішкі энергияның жүйенің күйіне тәуелділігі.
- •1. Адиабаттық процесс. Пуассон теңдеуі.
- •2. Жылудың механикалық жұмысқа айналуы. Циклдік процестер. Цикл жұмысы.
- •3. Жылуөткізгіштік. Фурье заңы. Жылуөткізгіштік коэффициентінің қысым мен температураға тәуелділігі.
- •2.Политроптық процесс.Политроп теңдеуі.
- •1. Политроптық процесс.Политроп теңдеуі.
- •2.Изотермдік процесс.Изотермдік процесс кезіндегі жұмыстың формуласы.
- •3.Тұтқырлық. Ньютонның үйкеліс заңы. Тұтқырлық коэффициентінің қысым мен температураға тәуелділігі.
- •1.Изохоралық процесс.
- •3.Ньютонның үйкеліс заңы. Тұтқырлық коэффициентінің қысым мен температураға тәуелділігі.
1.Изохоралық процесс.
Изохоралық процесс кезінде газға берілетін энергия:
Тұрақты көлемдегі газдың меншікті жылу сыйымдылығы:
Изохоралық процесс кезіндегі берілген жылу мөлшері:
Бір атомды идеал газ үшін:
Газ күйінің тұрақты көлемде (V =const) өзгеруі изохоралық процесс делінеді. Бұл процесс Шарль заңымен сипатталады. Газдың көлемі тұрақты болса, қысымы температураға пропорционал болады.
(3)
3– сурет. Изохоралық процесс
мұндағы - қысымның термиялық коэффициенті. Графигі изохора делінеді. (.3- сурет).
Газ күйінің өзгерісі тек тұрақты массада өтетін болса, атап айтқанда 1 моль, ал басқа параметрлерінің барлығы өзгеретін жағдайда, газ параметрлерінің өзара байланысы төмендегідей теңдеу арқылы берілетіндігі тәжірибеде дәлелденген:
(.4)
Бұл теңдеуді 1834 жылы француз инженері Клапейрон қорытып шығарған. Осы формуладағы V көлем орнына V0 молярлық көлемді алған жағдайда
(5)
(4) теңдіктің оң жағындағы тұрақты шаманың мәнін анықтап жазсақ, ол универсал газ тұрақтысына тең, яғни
мұндағы R-универсал газ тұрақтысы, R=8,31Дж/мольК. Бұл теңдеуді 1875 жылы Менделеев қорытып шығарған. Егер газдың 1 молінің V0 көлеміндегі газ массасы м (молярлық масса) болса, V көлемдегі газ массасы m болады. Ендеше m массалы газ көлемі
(6)
болады.Онда кез келген m массалы газ үшін Менделеев-Клапейрон теңдеуі былай жазылады:
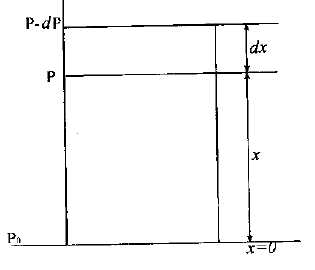
2.Барометрлік формула Молекулалардын, хаостық қозғалысының арқасында газ бөлшектері ыды-стың көлемінде бІркелкі таралды, сөйтіп ыдыстың көлемінің әрбІр бірлігінде орташа есеппен болшектердің бірдей саны болады. Тепе-тендік күйде газдың кысымы мен тем пературасы да көлемнің өне бойында бІрдей болады. Бірақ мүндай жағдай, тек сыртқы күштер эсер етпейтін кезде ғана болады. Сыртқы күштер бар кезде молекулалардын қозғалысы газға басқа сипат береді. Ауырлық өрісінде орналсқан газды (ауаны) қарастырайык, Егер молекулалардын жылулық қозғалысы болмаған болса, онда ауырлық күшінің әсер-інен олардың барлығы да Жерге қүлап түсіп, ауа тек Жердің тікелей бетінде жүқа қабат түрінде орналасқан болар еді. Егер ауырлық күші болмай, тек молекулалардын, жылулык қозғалысы ғана болатын болса, онда молекулалар әлемдік кеңістікке таралып кетер еді. Жердің ауа қабаты, атмосфераның осы күнгі күйінде болуы молекулалардын, жылулық қозғалысынын жөне олар-дың Жерге тартылуының бір мезгілде болуының аркасында. Осы кезде ат-мосферада молекулалардың биіктік бойынша белгілі таралуы калыптаскан және газдың қысымы белгілІ зандылыкпен биіктік бойынша өзгеріп отыра-ды. Енді осы заңдылықты шығарайық.
|
Ауаньщ
вертикал бағанасын карастырайық
Жер бетінде, |
Кинетикалық теориядан білетініміздей,
![]() болады.
Демек,
жөне
болады.
Демек,
жөне ![]() немесе,
немесе,
![]() (1.14)
(1.14)
![]() (1.14а)
С
- интегралдау түрақтысы.
Осыдан:
(1.14а)
С
- интегралдау түрақтысы.
Осыдан:
![]() (1.14в)
Егер
температураны барлық биіктіктерде
бірдей деп алатын болсақ, онда осы
теқдікті интегралдап, мынаған
келеміз:
Стұрақты
(1.14в)
Егер
температураны барлық биіктіктерде
бірдей деп алатын болсақ, онда осы
теқдікті интегралдап, мынаған
келеміз:
Стұрақты![]() кезінде
қысымның
кезінде
қысымның![]() болатындығы
шартымен
анықталады.
(1.14,в) теңдеуге
болатындығы
шартымен
анықталады.
(1.14,в) теңдеуге![]() және
және![]() шамаларының
осы мәндерІн қойып, мынаған
келеміз:
шамаларының
осы мәндерІн қойып, мынаған
келеміз:
![]() демек,
қысымның Жер бетінде биіктікке төуелділігі
үшін орнек теменде-гідей
болады:
демек,
қысымның Жер бетінде биіктікке төуелділігі
үшін орнек теменде-гідей
болады:
![]() (1.15)
Егерде
(1.15)
Егерде![]() екендігін
ескерсек (мұндағы
екендігін
ескерсек (мұндағы![]() -
молдік масса,
-
молдік масса,
![]() Авогадро
саны), онда:
Авогадро
саны), онда:
![]() Кысымнын
биіктікке тәуелді түрде өшетінін
көрсететін (1.15) өрнек барометрлік
өрнек деп
аталады. Осы өрнектен көріп отырғанымыздай,
газ қысымы биіктікке байланысты
экспонента түрінде азаяды екен.
Кысымнын
биіктікке тәуелді түрде өшетінін
көрсететін (1.15) өрнек барометрлік
өрнек деп
аталады. Осы өрнектен көріп отырғанымыздай,
газ қысымы биіктікке байланысты
экспонента түрінде азаяды екен.