
- •1 .Орташа арифметикалық жылдамдығын, орташа квадраттық жылдамдығын және ең ықтимал жылдамдықтарды анықтайтын өрнектерін салыстырып, осы есептелген үш жылдамдықтар арасындағы байланысты талдаңыз.
- •1.Бірінші текті фазалық ауысулар.Фазалық тепе-теңдік сызығы.Клапейрон- Клаузиус теңдеуі
- •3. Идеал газ күйінің теңдеуі, оның жалпы анықталмаған түрі. Қысымның газдың сандық тығыздығымен байланысы.
- •2.Максвеллдің үлестірілу функциясының жылдамдықтың х –компоненті үшін түрі.
- •3.Жылу молшері. Жылу мөлшерінің процеске катысты анықталуы.
- •1. Изобарлық процестегі жылусыйымдылық. Майер теңдеуі.
- •1.Изохоралық процесс.
- •2. Идеал газдардың жылу сыйымдылығы.
- •3. Заттың құрылымдық элементтері. Зат молшері – моль.
- •2. Температура түсініктемесі. Температуралық шкала, реперлік нүктелер, температураны
- •3.Термодинамиканың 2 бастамасы жане оның физикалық мағынасы.
- •3.Еркіндік дәрежелер саны. Газдардың жылусыйымдылығы арасындағы қатынастар
- •3.Энергияның тең үлестірілу заңы.
- •2. Термодинамиканың екінші бастамасының статистикалық сипаты. Энтропияның физикалық мағынасы
- •3.Материялық денелердің молекула-кинетикалық моделі. Атомдар мен молекулалар массасы.
- •1. Зат қасиеттерінің құрылымы мен моле-дың жылулық қозғалыспен байланысы.
- •1. Карно циклі. Карно циклінің пайдалы әсер коэффициенті. Карно теоремасы.
- •3. Молекулааралық өзара әрекеттесу күштері. Алыстан және жақыннан әсерлесу күштері. Күштердің молекулааралық қашықтыққа тәуелділігі.
- •1.Сиретілген газдардағы физикалық құбылыстар
- •3.Молекулааралық өзара әрекеттесу күштері.Күштердің молекулааралық қашықтыққа тәуелділігі.
- •2.Газдардағы еркін жүру жолы мен орташа соқтығысу саны
- •3.Адиабаталық процесстегі жұмыстың формуласы
- •1. Концентрация. Көлемдік, салыстырмалы мольдік, салыстырмалы массалық концентрация.Парциал қысым және оның қоспадағы мольдік үлесімен байланысы. Дальтон заңы
- •3.Идеал газдың ішкі энергиясы. Ішкі энергияның жүйенің күйіне тәуелділігі.
- •1. Адиабаттық процесс. Пуассон теңдеуі.
- •2. Жылудың механикалық жұмысқа айналуы. Циклдік процестер. Цикл жұмысы.
- •3. Жылуөткізгіштік. Фурье заңы. Жылуөткізгіштік коэффициентінің қысым мен температураға тәуелділігі.
- •2.Политроптық процесс.Политроп теңдеуі.
- •1. Политроптық процесс.Политроп теңдеуі.
- •2.Изотермдік процесс.Изотермдік процесс кезіндегі жұмыстың формуласы.
- •3.Тұтқырлық. Ньютонның үйкеліс заңы. Тұтқырлық коэффициентінің қысым мен температураға тәуелділігі.
- •1.Изохоралық процесс.
- •3.Ньютонның үйкеліс заңы. Тұтқырлық коэффициентінің қысым мен температураға тәуелділігі.
3.Идеал газдың ішкі энергиясы. Ішкі энергияның жүйенің күйіне тәуелділігі.
Идеал газдың молекуласының орташа энергиясы (2.5 бап) былай анықталады:
 ,
(2.47) мұндағы
– Больцман тұрақтысы,
,
(2.47) мұндағы
– Больцман тұрақтысы,
 – газдың температурасы,
–молекула массасы,
– газдың температурасы,
–молекула массасы,
 – молекуланың орташа квадраттық
жылдамдығы.Бұл теңдеу молекулалары
материялық нүктелер және олар тек
ілгерілемелі қозғалыста деп есептелетін
идеал біратомды газ үшін жазылған. Егер
газдың молекулалары бірден көп атомдардан
құралған болса, мұндай көпатомды молекула
айналмалы және тербелмелі қозға-лыста
болуы мүмкін, онда бұл қозғалыстармен
байланысты энергияны ескеру қажет.Біз
алдымен біратомды газды қарастырамыз
және оның белгілі массасындағы заттың
барлық молекулаларының энергиясын
анықтай-тын өрнекті табамыз. Егер газ
молекуладан құралса, онда олардың жалпы
– молекуланың орташа квадраттық
жылдамдығы.Бұл теңдеу молекулалары
материялық нүктелер және олар тек
ілгерілемелі қозғалыста деп есептелетін
идеал біратомды газ үшін жазылған. Егер
газдың молекулалары бірден көп атомдардан
құралған болса, мұндай көпатомды молекула
айналмалы және тербелмелі қозға-лыста
болуы мүмкін, онда бұл қозғалыстармен
байланысты энергияны ескеру қажет.Біз
алдымен біратомды газды қарастырамыз
және оның белгілі массасындағы заттың
барлық молекулаларының энергиясын
анықтай-тын өрнекті табамыз. Егер газ
молекуладан құралса, онда олардың жалпы
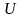 энергиясы мынаған тең болады:
энергиясы мынаған тең болады:
 .
(6.2)
.
(6.2)
Бір
моль газ үшін (6.2)-ші өрнектің түрі былай
жазылады:
 ,
мұндағы
,
мұндағы
 – универсал газ тұрақтысы,
– универсал газ тұрақтысы,
 – Авогадро саны.
– Авогадро саны.
Осы (6.3) өрнекпен анықталатын энергияны идеал газдың (бір молі үшін) ішкі энергиясы деп атайды. Жалпы жағдайда дененің ішкі энергиясы деп, оның құрамындағы молекулаларына қатысты “көзге көрінбейтін” энергиясын айтады. Сондықтан дененің немесе денелер жүйесінің ішкі энергиясы заттың құрамындағы барлық қозғалыстағы молекулаларының кинетикалық энергиясы, молекуланың атомдарының қозғалысының кинетикалық энергиясы (молекула көпатомды болса) мен ондағы молекулалардың өзара әрекеттесуінің потенциалдық энергиясы және атомның құрамы-на кіретін микробөлшектердің кинетикалық және потенциалдық энергиясы да ескерілуі мүмкін. Бірақ, бұған газдың тұтас дене ретіндегі қозғалысының кинетикалық энергиясы және сыртқы күштер өрісінде орналасқандағы потенциалдық энергиясы қосылмайды.Идеал газдың белгілі массасының ішкі энергиясы (6.2) және (6.3) өрнектер бойынша тек температураға тәуелді, газдың қысымы мен көлеміне тәуелді емес. Нақты газдар үшін бұл айтылғандар орындал-майды.Идеал газдың температурасын өзгерту үшін, оның ішкі энергиясын өзгерту керек екендігі, осы (6.2) және (6.3)-ші формуладан көрінеді. Ал механикадан белгілі, энергияның өзгеруі жұмыс істеумен байла-нысты: дененің энергиясы өзгереді, егер дене жұмыс істесе немесе дененің үстінен жұмыс істелсе, онда осы энергия өзгерісі істелген жұмысқа тең болады. Олай болса, газдың немесе кез келген дененің температурасының өзгеруі тек механикалық жұмыс істелгенде байқа-лады деп ойлауға болады. Мәселен, денені қыздыру үшін оның үсті-нен жұмыс істелуі қажет, ал суыту үшін дене өзі жұмыс істеуі керек. Дененің температурасын өзгертуге болады, егер қажетті механикалық жұмысты жұмсаса. Мысалы, бір-бірімен үйкелетін денелер қызатыны көне заманнан белгілі.
№17 билет
1. Адиабаттық процесс. Пуассон теңдеуі.
Адиабаттық
процесте газдың қысымы мен көлемінің
өзгерісі Бойль-Мариот заңына бағынбайды.
Бұл процесте температура өзгеріп
отырады.
 бойынша
бойынша
 .
Бұл теңдеуді шешу үшін dT-ның өзгерісін
анықтау қажет. Идеал газ күйінің теңдеуі
PV=RT қолд. Осы теңдеуді дифференциалдап,
pdV+Vdp=RdT температураның өзгерісі dT-ны
анықтаймыз:
.
Бұл теңдеуді шешу үшін dT-ның өзгерісін
анықтау қажет. Идеал газ күйінің теңдеуі
PV=RT қолд. Осы теңдеуді дифференциалдап,
pdV+Vdp=RdT температураның өзгерісі dT-ны
анықтаймыз:
 ,
сонда
,
сонда

R
орнына
 мәнін
ауыстырып,
мәнін
ауыстырып,
 өрнегін аламыз.
өрнегін аламыз.
Жылусыйымдылықтар қатынасын:
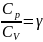 қолданып,
қолданып,
 формуланы мына түрде жазамыз. Егер
формуланы мына түрде жазамыз. Егер
 тұрақты
болса, осы теңдеуді былай жазамыз:
тұрақты
болса, осы теңдеуді былай жазамыз:

Бұл
теңдеуді интегралдап, мына түрге
келтіреміз:
 .
Ақырында потенциалдасақ, сонда өрнекті
былай жазамыз:
.
Ақырында потенциалдасақ, сонда өрнекті
былай жазамыз:
 .
Бұл теңдеу адиабаттық процесс кезінде
идеал газ көлемі өзгергенде қысым мен
көлем арасындағы тәуелділікті
тағайындайды. Бұл өрнек Пуассон
теңдеуі
немесе адиабаттық процестегі идеал газ
күйінің теңдеуі деп аталады, мұндағы
- адиабаттық көрсеткіш деп аталады.
.
Бұл теңдеу адиабаттық процесс кезінде
идеал газ көлемі өзгергенде қысым мен
көлем арасындағы тәуелділікті
тағайындайды. Бұл өрнек Пуассон
теңдеуі
немесе адиабаттық процестегі идеал газ
күйінің теңдеуі деп аталады, мұндағы
- адиабаттық көрсеткіш деп аталады.
б) p=f(V) диаграммадағы жұмыстың графиктік бейнелеуі.
Қысым мен көлем арасындағы байланыс адиабат теңдеуі, демек Пуассон теңдеуі бойынша анықталады:
Бұл теңдеуді былай жазуға болады:

Мұндағы
 газдың
бастапқы қысымы,
газдың
бастапқы қысымы,
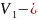 бастапқы
көлемі. Осыдан
бастапқы
көлемі. Осыдан

Қысымның осы мәнін жұмысты анықтайтын өрнекке қоямыз, сонда

Газдың
көлемі
 ге
дейін ұлғайғандағы істеген жұмысты,
осы теңдеуге қоямыз. Осы көлемдер
аралығында интегралдап, табамыз:
ге
дейін ұлғайғандағы істеген жұмысты,
осы теңдеуге қоямыз. Осы көлемдер
аралығында интегралдап, табамыз:
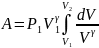
Интегралдың оң жағы мынаған тең болады:

Осыны А жұмысты анықтайтын өрнекке қоямыз:

газдың
бастапқы қысымын Менделеев -
Клайперон теңдеуінен анықтап
 ,
соңында
мына өрнекке келеміз:
,
соңында
мына өрнекке келеміз:

Егер
 қолд. болсақ, онда
қолд. болсақ, онда
 теңдеуі
теңдеуі
 Олай
болса, көлемі адиабаттық өзгергенде
газдың істеген жұмысын былай анықтаймыз:
Олай
болса, көлемі адиабаттық өзгергенде
газдың істеген жұмысын былай анықтаймыз:
 Мұндағы
Мұндағы


