
- •1 .Орташа арифметикалық жылдамдығын, орташа квадраттық жылдамдығын және ең ықтимал жылдамдықтарды анықтайтын өрнектерін салыстырып, осы есептелген үш жылдамдықтар арасындағы байланысты талдаңыз.
- •1.Бірінші текті фазалық ауысулар.Фазалық тепе-теңдік сызығы.Клапейрон- Клаузиус теңдеуі
- •3. Идеал газ күйінің теңдеуі, оның жалпы анықталмаған түрі. Қысымның газдың сандық тығыздығымен байланысы.
- •2.Максвеллдің үлестірілу функциясының жылдамдықтың х –компоненті үшін түрі.
- •3.Жылу молшері. Жылу мөлшерінің процеске катысты анықталуы.
- •1. Изобарлық процестегі жылусыйымдылық. Майер теңдеуі.
- •1.Изохоралық процесс.
- •2. Идеал газдардың жылу сыйымдылығы.
- •3. Заттың құрылымдық элементтері. Зат молшері – моль.
- •2. Температура түсініктемесі. Температуралық шкала, реперлік нүктелер, температураны
- •3.Термодинамиканың 2 бастамасы жане оның физикалық мағынасы.
- •3.Еркіндік дәрежелер саны. Газдардың жылусыйымдылығы арасындағы қатынастар
- •3.Энергияның тең үлестірілу заңы.
- •2. Термодинамиканың екінші бастамасының статистикалық сипаты. Энтропияның физикалық мағынасы
- •3.Материялық денелердің молекула-кинетикалық моделі. Атомдар мен молекулалар массасы.
- •1. Зат қасиеттерінің құрылымы мен моле-дың жылулық қозғалыспен байланысы.
- •1. Карно циклі. Карно циклінің пайдалы әсер коэффициенті. Карно теоремасы.
- •3. Молекулааралық өзара әрекеттесу күштері. Алыстан және жақыннан әсерлесу күштері. Күштердің молекулааралық қашықтыққа тәуелділігі.
- •1.Сиретілген газдардағы физикалық құбылыстар
- •3.Молекулааралық өзара әрекеттесу күштері.Күштердің молекулааралық қашықтыққа тәуелділігі.
- •2.Газдардағы еркін жүру жолы мен орташа соқтығысу саны
- •3.Адиабаталық процесстегі жұмыстың формуласы
- •1. Концентрация. Көлемдік, салыстырмалы мольдік, салыстырмалы массалық концентрация.Парциал қысым және оның қоспадағы мольдік үлесімен байланысы. Дальтон заңы
- •3.Идеал газдың ішкі энергиясы. Ішкі энергияның жүйенің күйіне тәуелділігі.
- •1. Адиабаттық процесс. Пуассон теңдеуі.
- •2. Жылудың механикалық жұмысқа айналуы. Циклдік процестер. Цикл жұмысы.
- •3. Жылуөткізгіштік. Фурье заңы. Жылуөткізгіштік коэффициентінің қысым мен температураға тәуелділігі.
- •2.Политроптық процесс.Политроп теңдеуі.
- •1. Политроптық процесс.Политроп теңдеуі.
- •2.Изотермдік процесс.Изотермдік процесс кезіндегі жұмыстың формуласы.
- •3.Тұтқырлық. Ньютонның үйкеліс заңы. Тұтқырлық коэффициентінің қысым мен температураға тәуелділігі.
- •1.Изохоралық процесс.
- •3.Ньютонның үйкеліс заңы. Тұтқырлық коэффициентінің қысым мен температураға тәуелділігі.
№1 билет
1 .Орташа арифметикалық жылдамдығын, орташа квадраттық жылдамдығын және ең ықтимал жылдамдықтарды анықтайтын өрнектерін салыстырып, осы есептелген үш жылдамдықтар арасындағы байланысты талдаңыз.
Молекулалардың
орташа арифметикалық жылдамдығын
есептеуге ұқсас есептеулер жүргізіп,
жылдамдықтың квадратының
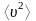 орташа мәнін анықтаймыз:
орташа мәнін анықтаймыз:
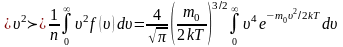 мұндағы
мұндағы

сондықтан молекулалардың орташа квадраттық жылдамдығы мынаған тең болады:
![]()
Демек

Бұл жылдамдық орташа арифметикалық жылдамдықпен тең бол-майды, шынында

Молекулалардың орташа кинетикалық энергиясы олардың жылдамдықтары арқылы анықталады. Есептеулер жоғарыда айтылғанға ұқсас, орташа кинетикалық энеригияның өрнегі мына түрде жазылады:

демек
2.Термодинамиканың бірінші бастамасы, физикалық мағынасы
Термодинамиканың бірінші бастамасы үйреншікті және соның өзінде ғажайып абстракты энергия ұғымын енгізеді. Жалпы айтқанда, бұл ұғым кез келген дененің жұмыс істеу қабілетін бейнелеп түсін-діреді, демек күш салуымен байланысты. Термодинамиканың негізін-де көптеген тәжірибелік деректердің жинағын жалпылау арқылы жылудың механикалық жұмысқа айналу мүмкіндігі көрсетіледі. XIX ғасырдың ортасында жылу мен жұмыстың эквиваленттілігі тағайын-далды. Сонымен, энергияның білінуінің түрлері анықталды. Осы тәжірибелік нәтижелерін Майер (1842 ж.) және Гельмгольц (1847 ж.) жалпылап, былай тұжырымдады: барлық макроскоптық жүйелер тұрақты энергия мөлшеріне ие болады және энергияның бір түрден екінші түрге өтуі мүмкін. Жүйенің энергиясының мөлшері тек оның сыртқы ортаға берілу немесе одан алыну нәтижесінде өзгереді. Осы тұжырым термодинамикада оның бірінші заңының негізгі мағынасын белгілейді.
3. Изотермдік жағдайда ауаның қысымының Жердің бетінен биіктікке тәуелділігі. Барометрлік формула (қорытыңыз).
Молекулалардың хаосты қозғалысы газдың микробөлшектердің ыдыстың көлемі бойынша біркелкі таралуына және бірлік көлемде, орташалап алғанда, молекулалар саны бірдей болуына әкеледі. Тепе теңдік күйде газдың қысымы мен температурасы барлық көлемде бірдей болады.
А тмосферадағы
молекулалардың биіктік бойынша
үлестірілуі белгілі заңға бағынады.
Бұл үлестіру былай анықталады. Жер беті
х=0,сондағы ауа қысымы
тмосферадағы
молекулалардың биіктік бойынша
үлестірілуі белгілі заңға бағынады.
Бұл үлестіру былай анықталады. Жер беті
х=0,сондағы ауа қысымы
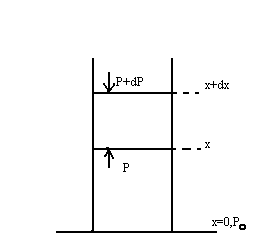
 дейік,ал х биіктіктегі қысым P-ға тең
дейік. Биіктік dx-қа өзгергенде қысым
dp-ға өзгереді. Ауаның кез келген
биіктіктегі қысымы p+dp , осы ауаның
вертикаль бағанасының бірлік ауданға
түсірген салмағына тең. Сондықтан
(p+dp)s+mg=ps. Онда кез келген биіктіктегі dp
қысым өзгерісі былай табылады;
дейік,ал х биіктіктегі қысым P-ға тең
дейік. Биіктік dx-қа өзгергенде қысым
dp-ға өзгереді. Ауаның кез келген
биіктіктегі қысымы p+dp , осы ауаның
вертикаль бағанасының бірлік ауданға
түсірген салмағына тең. Сондықтан
(p+dp)s+mg=ps. Онда кез келген биіктіктегі dp
қысым өзгерісі былай табылады;
Sdp+mg=Sdp+ρVg=0 немесе dp= - ρgdx
 Мұндағы
v-ауаның dx вертикаль баңанасының көлемі,
V=Sdx; ρ-ауа тығыздығы, g-ауырлық күшінің
үдеуі. Ρ=
Мұндағы
v-ауаның dx вертикаль баңанасының көлемі,
V=Sdx; ρ-ауа тығыздығы, g-ауырлық күшінің
үдеуі. Ρ= n;
p=nkT→n=
n;
p=nkT→n= (2)
(2)
Ρ= (3)T-ауа темп-ы, k-больцман тұрақт.(3) ескеріп,
(2) былай жазамыз. dp= -
(3)T-ауа темп-ы, k-больцман тұрақт.(3) ескеріп,
(2) былай жазамыз. dp= -
 →
→

Барлық
биіктік б/ша T=const болса,
 нтегралдап, қысымды х биіктік-ң функциясы
түрінде анық-з:
нтегралдап, қысымды х биіктік-ң функциясы
түрінде анық-з:
 н/е потенциал қысым табамыз:P=C
н/е потенциал қысым табамыз:P=C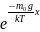 ;
(5) С-интегралдау тұрақтысы,
;
(5) С-интегралдау тұрақтысы,

Изотермдік жағдайда ауаның қысымының Жердің бетінен биіктікке тәуелділігінің түрі былай өрнектеледі:
P=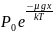 (6)
=
(6)
= ескерсек, P=
ескерсек, P= (7)M ауаның мольдік массасы, R-универсал
газ тұрақтысы (6) және (7) барометрлік
формула.
(7)M ауаның мольдік массасы, R-универсал
газ тұрақтысы (6) және (7) барометрлік
формула.
Барометрлік формула ауырлық өрісінде атмосф-қ қысымның биіктік б/ша төмендеу заңын тағайындайдайды.
№2билет
