- •8. Классификация элементов по электронным семействам
- •9.Периодический закон и периодическая таблица химических элементов.
- •10. Радиусы атомов и ионов
- •11. Элетктроотрицательность
- •12. Ионизационные потенциалы
- •13. Сродство к электрону
- •14, 15, 16,19.Химическая связь, ее типы
- •Химическая связь - это взаимное сцепление атомов в молекуле и кристаллической решётке в результате действия между атомами электрических сил притяжения.
- •17. Межмолекулярные связи
- •22. Кристаллические решетки
- •23. Тепловой эффект
- •24. Закон Гесса
- •27.Скорость химических реакций. Факторы, влияющие на скорость химической реакции
- •Зависимость скорости реакций от различных факторов
- •28. Закон действия масс
- •29. Уравнение Вант-Гоффа
- •30. Уравнение Аррениуса. Энергия активации
- •33. Общие сведение о растворах. Растворимость
- •37.Диффузия и осмос. Уравнение Вант- Гоффа
- •46.Окислительно-восстановительные реакции Метод электронного баланса
- •49. Основные виды коррозии.
- •50. Методы защиты металлов от коррозии
- •52.Важнейшие представители полимров, методы их получения. Применение полимеров на транспорте
- •53. Физическо-химические свойства полимеров
- •54.Электролиз. Законы Фарадея
- •55. Метод химической идентификации веществ
Ответы по химии
1.основы квантовой теории
теория, основы который были заложены в 1900 физиком Максом Планком. Согласно этой теории, атомы всегда излучают или принимают лучевую энергию только порциями, прерывно, а именно определенными квантами (кванты энергии), величина энергии которых равна частоте колебаний (скорость света, деленная на длину волны) соответствующего вида излучения, умноженной на планковский квант действия. Квантовая теория была положена (гл. о. Эйнштейном) в основу квантовой теории света (корпускулярная теория света), по которой свет также состоит из квантов, движущихся со скоростью света (световые кванты, фотоны).
2. характеристика квантовых чисел
1)Главное
квантовое число (n) — характеризует
энергию и размер орбитали. Оно принимает
значения от 1 до ![]() :
n = 1, 2, 3, 4, 5, 6, 7.
:
n = 1, 2, 3, 4, 5, 6, 7.
2)Побочное (орбитальное) квантовое число (1) - характеризует форму орбиталей и принимает значения от 0 до (n - 1): 1 = О, 1, 2, 3, 4. Например, если n = 2, то 1 имеет 2 значения: О, 1. Значит, на 2 энергетическом уровне есть сферическая орбиталь (1 = 0) и в виде объемной восьмерки (гантелеобразная) (1 = 1).
3)Магнитное квантовое число (m) - характеризует количество орбиталей одинаковой формы и ориентацию их в электромагнитном поле ядра атома. Оно принимает значения в интервале от —1 до +1. Для каждого значения разрешено (21 + 1) значений числа m. Например, если 1 = 1, то m имеет (2 x 1 + 1) 3 значения: — 1,0, +1.
4)Спиновое
квантовое число (s) - характеризует
вращение электрона вокруг своей оси и
принимает только 2 значения: +1/2 (
)
и -1/2 (![]() ).
(Спин электрона — свойство электрона
вести себя как крошечный магнит).
).
(Спин электрона — свойство электрона
вести себя как крошечный магнит).
3.Правило Гунда
Правило Гунда (Хунда) . Заполнение электронами ячеек p-, d- и f-подуровней вначале происходит неспаренными электронами, и лишь после такого заполнения подуровня начинается вхождение в ячейки вторых электронов (с противоположными спиновыми квантовыми числами) , т. е. происходит их спаривание.
4.Принцип Паули
Принцип Паули можно сформулировать следующим образом: в пределах одной квантовой системы в данном квантовом состоянии может находиться только одна частица, состояние другой должно отличаться хотя бы одним квантовым числом. Вообще, принцип Паули является критерием к разделению частиц==>он справедлив для "всех" частиц
Запрет Паули: в атоме не может быть двух электронов, имеющих одинаковый набор всех четырех квантовых чисел. Принцип Паули означает, что на орбитали может находиться не более двух электронов. На s-подуровне (1 орбиталь) может находиться 2 электрона, на p-подуровне (3 орбитали) – 6 электронов, на d-подуровне (5 орбиталей) – 10 электронов, на f-подуровне (7 орбиталей) – 14 электронов. Максимальное число электронов на энергетическом уровне составляет 2n2, где n – главное квантовое число.
5. Принцип наименьшей энергии: электроны в первую очередь заполняют свободные орбитали с наименьшей энергией.
Атомные орбитали располагаются в порядке увеличения их энергии следующим образом: 1s2 <2s2 <2p6<3s2<3p6<4s2<3d104p6<5s2<4d10<5p6<6s2<4f14<5d10<6p6<7s2<5f14<6d10.
В многоэлектронных атомах энергия орбиталей определяется не только взаимодействием электронов с ядром, но и взаимодействием электронов между собой. Это проводит к появлению ряда нарушений вышеприведенной последовательности у отдельных d и f-элементов. Явление носит название провал электрона; проявляется в заполнении орбиталей с более высокой энергией при наличии незаполненных орбиталей с более низкой энергией.
6.Правило Клечковского
Правило n + l, или правило Клечковского. Энергия электрона в атоме определяется значениями главного n и побочного l квантовых чисел, поэтому сначала заполняются электронами те энергетические уровни и подуровни, для которых сумма значений квантовых чисел n + l минимальна. Если для двух подуровней одного или разных уровней суммы n + l равны, то сначала заполняется подуровень с меньшим значением n.
7.Определение валентности атомов. Нормальное и возбужденное состояние атомов
В химии валентными электронами называют электроны, находящиеся на внешней, или валентной, оболочке атома. Валентные электроны определяют поведение химического элемента в химических реакциях. Чем меньше валентных электронов имеет элемент, тем легче он отдаёт эти электроны (проявляет свойства восстановителя) в реакциях с другими элементами. И наоборот, чем больше валентных электронов содержится в атоме химического элемента, тем легче он приобретает электроны (проявляет свойства окислителя) в химических реакциях при прочих равных условиях. Полностью заполненные внешние электронные оболочки имеют инертные газы, которые проявляют минимальную химическую активность. Периодичность заполнения электронами внешней электронной оболочки определяет периодическое изменение химических свойств элементов в таблице Менделеева.
Количество валентных электронов (максимальная валентность) равно номеру группы в периодической таблице Менделеева, в которой находится химический элемент (кроме побочных подгрупп).
Электронной формулой: различие в состоянии электронов внешнего слоя. Атом, получая дополнительную энергию, переходит из основного состояния в возбуждённое. При этом спаренные электроны на внешнем слое расспариваются, и один из них занимает следующую свободную орбиталь (этого же или следующего электронного подуровня) . Например, у серы может быть 2 возбуждённых состояния: S ...3s2 3p4 + E -> S* ...3s2 3p3 3d1 + E -> S** ...3s1 3p3 3d2 (указываю строение только внешнего электронного слоя; Е - энергия, которую использует атом для перехода в возбуждённое состояние; звёздочками указаны первое и второе возбужденные состояния атома) Итак, в основном состоянии атом серы имеет 2 неспаренных р-электрона и проявляет валентность 2; в первом возбуждённом состоянии - 4 неспаренных электрона и валентность 4 (спарены только s-электроны) ; во втором возбуждённом состоянии на внешнем слое атома все электроны неспаренные, валентность 6. Кстати, атомы азота, кислорода, фтора и неона не имеют возбуждённых состояний, т. к. у этих элементов нет свободных р-орбиталей, а на d-подуровень электроны перейти не могут, т. к. на втором энергетическом уровне (это элементы 2 периода) нет d-подуровня. По той же причине нет возбужденных состояний у атомов водорода и гелия: у элементов первого периода - лишь один энергетический уровень, содержащий только одну s-орбиталь.
8. Классификация элементов по электронным семействам
Это связь между положением элемента в периодической системе и электронным строением его атомов. От того, какой энергетический подуровень заполняется последним, различают 4 электронных семейства элементов: s, p, d и f: 1. s-Элементы – семейство элементов, у которых при заполнении электронных уровней электронами, последний электрон идет на внешний s-подуровень. Это первая и вторая группа главной подгруппы. На внешнем энергетическом уровне у них 1 или 2 электрона. Например, Na: 14s2 2s2 p6 3s1, валентным является один s-электрон. 2. У p-элементов последний электрон идет на p-подуровень внешнего уровня. Это элементы III - VIII групп главной подгруппы каждого периода. 3. У d-элементов сначала заполняется s-подуровень внешнего уровня, а последний электрон идет на d-подуровень предвнешнего уровня. d-Элементы находятся в побочных подгруппах п. с. (У d-элементов возможен проскок электронов с s-подуровня внешнего уровня на свободную d-орбиталь предвнешнего уровня, если это энергетически выгодно. ) 4. У f-Элементов последний электрон идет на f-подуровень предпредвнешнего уровня. К ним относятся лантаноиды и актиноиды.
9.Периодический закон и периодическая таблица химических элементов.
Открытие Периодического закона
Основной закон химии - Периодический закон был открыт Д.И. Менделеевым в 1869 году в то время, когда атом считался неделимым и о его внутреннем строении ничего не было известно.
В основу Периодического закона Д.И. Менделеев положил атомные массы (ранее - атомные веса) и химические свойства элементов.
Расположив 63 известных в то время элемента в порядке возрастания их атомных масс, Д.И. Менделеев получил естественный (природный) ряд химических элементов, в котором он обнаружил периодическую повторяемость химических свойств.
Например, свойства типичного металла литий Li повторялись у элементов натрий Na и калий K, свойства типичного неметалла фтор F - у элементов хлор Cl,бром Br, иод I.
У некоторых элементов Д.И. Менделеев не обнаружил химических аналогов (например, у алюминия Al и кремния Si), поскольку такие аналоги в то время были еще неизвестны. Для них он оставил в естественном ряду пустые места и на основе периодической повторяемости предсказал их химические свойства. После открытия соответствующих элементов (аналога алюминия - галлия Ga, аналога кремния - германия Ge и др.) предсказания Д.И. Менделеева полностью подтвердились.
Периодический закон в формулировке Д.И. Менделеева:
Свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величины атомных весов элементов. |
На основе Периодического закона Д.И. Менделеев создал Периодическую систему химических элементов.
10. Радиусы атомов и ионов
Атомные радиусы разделяют на металлические, которые мы находим в металлах, сплавах или интерметаллических (?) соединениях, и ковалентные, характерные для неметаллов и вообще для ковалентных молекул.
Ковалентные радиусы в свою очередь подразделяют на тетраэдрические, октаэдрическиеи т.д. Безусловно нужно различать радиусы при одинарной, двойной и тройной связях. Существуют ещё атомные радиусы по Брэггу–Слейтеру и орбитальные радиусы.
Ван-дер-ваальсовы радиусы следует рассматривать как радиусы несвязанных атомов. Их находят по межатомным расстояниям в твердом теле или жидкости, где атомы находятся в непосредственной близости друг от друга, но не связаны между собой ионной, ковалентной или металлической связью.
Ковалентные радиусы
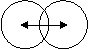 За
ковалентный радиус атома при
одинарной связи принимают половину
расстояния между ядрами 2х одинаковых
атомов, связанных ковалентной связью.
За
ковалентный радиус атома при
одинарной связи принимают половину
расстояния между ядрами 2х одинаковых
атомов, связанных ковалентной связью.
Так, длина
связи С – С в алмазе и в органических
молекулах равна
![]() откуда
R = 1,54:2 = 0,77 А°.
откуда
R = 1,54:2 = 0,77 А°.
например:
RSi = 1,17 А°
RC–Si = 1,94 А°
RCl–Br = 2,14 А°
RS – Cl = 2,04 А°
При двойных или тройных связях, как у:
![]()
![]()
![]()
![]()
![]()
т.е. укорочение связи можно наблюдать при увеличении кратности.
Ионные радиусы
Измерить межъядерное расстояние в молекуле несложно, но решить какая часть этого расстояния приходится на долю катиона, а какая на долю аниона, далеко не просто.
|
|
|
|
С помощью карты электронной плотности заряда были определены радиусы для катионов и анионов. Например:
соединение |
R катиона |
R аниона |
|
|
NaCl |
1,18 |
1,64 |
|
KCl |
1,45 |
1,70 |
|
LiF |
0,92 |
1,09 |
|
MgO |
1,02 |
1,09 |
|
CuCl |
1,10 |
1,25 |
|
|
|
|
При решении уравнений, предложенных Полингом было найдено значение ионных радиусов:
Ион |
Na+ |
K+ |
Rb+ |
Cs+ |
F– |
Cl– |
Br– |
J– |
r, A° |
0,95 |
1,33 |
1,48 |
1,69 |
1,36 |
1,81 |
1,95 |
2,16 |
Эти значения называют одновалентными радиусами. (для щелочных Ме и галогенов).
По Брэггу
(1920г) межъядерное расстояние в кристалле
можно рассматривать как сумму радиусов.
Ионный радиус отличаются от атомных
(Это определил Слейтер) на
![]() А°,
определив радиус у 1200 соединений.
А°,
определив радиус у 1200 соединений.
Атомные радиусы нужно применять в том случае, когда атомы соединены ковалентной или металлической связью. Это связывание осуществляется, если атомы приближаются друг к другу на расстояние, когда каждый атомный радиус примерно равен радиусу максимума радиальной плотности заряда.
Ионные радиусы используются в том случае, когда внешний электрон полностью удален с внешней орбитали электроотрицательного атома.
Периодичность атомных и ионных R. Для групп непероходных элементов атомные и ионные радиусы увеличиваются с увеличением порядкового номера (Z). Наибольшее увеличение имеет место для двух наиболее легких членов группы (Li и Be) и наименьшее для двух наиболее тяжелых членов группы. Но при изменении атомных и ионных радиусов по периодам они в общем уменьшаются при увеличении заряда ядра (Z). Наибольшее уменьшение наблюдается у элементов малых периодов, т.к. у них происходит заполнение внешнего электронного слоя. В больших периодах в пределах семейств d- и f- элементов наблюдается более плавное уменьшение радиусов. Это уменьшение называют соответственно d и f сжатием, (т.к. эти элементы имеют электроны, обладающие малой экранирующей способностью).