
- •Біосинтез вуглеводів
- •1. Утворення глюкози з пірувату.
- •Метаболізм ліпідів у клітинах.
- •1. Гідроліз жирів.
- •1.1. Окислення гліцерину.
- •1.2. Окислення жирних кислот.
- •2. Біосинтез жирів.
- •2.1. Біосинтез жирних кислот
- •2.2. Біосинтез гліцерину.
- •2.3. Біосинтез триацилгліцеридів.
- •2.4. Біосинтез фосфогліцеридів.
- •Розпад білків
- •Метаболізм амінокислот у живих організмах.
- •1. Розклад амінокислот за аміногрупою:
- •1.2.1. Окислювальне дезамінування.
- •1.2.2. Відновне дезамінування.
- •1 .2.3. Гідролітичне дезамінування.
- •1.2.4. Внутрішньомолекулярне переамінування.
- •2. Розклад амінокислот за карбоксильною групою:
- •Утворення кінцевих продуктів білкового обміну.
- •Орнітиновий цикл (цикл сечовини)
- •Біосинтез амінокислот
- •Біосинтез білків.
1.2.1. Окислювальне дезамінування.
В організмі вищих тварин головним чином відбувається окислювальне дезамінування амінокислот, яке супроводжується утворенням -кетокислот і аміаку.
Оскільки аміногрупи за допомогою трансаміназ в основному зібрані у вигляді -аміногруп L-глутамінової кислоти, то найчастіше в організмі тварин проходить окислювальне дезамінування цієї амінокислоти, яке каталізується НАД-залежною глутаматдегідрогеназою:
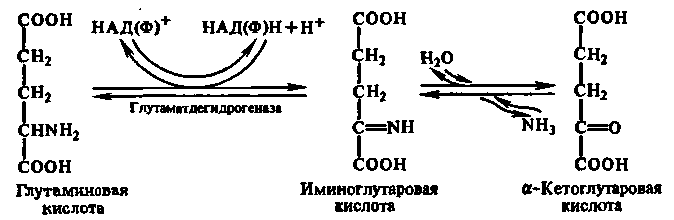
Процес окислювального дезамінування здійснюється в дві стадії. Спочатку амінокислота окислюється в імінокислоту за участю специфічної дегідрогенази з НАД+ або НАДФ+ в якості коферменту і акцептора водню. Потім імінокислота спонтанно гідролізується на кетокислоту і аміак.
Внаслідок цієї реакції аміногрупи, зібрані з амінокислот, виділяються у вигляді іонів NH4+. Глутаматдегідрогеназна реакція є оборотною і при певних умовах може відбуватися амінування -кетоглутарової кислоти.
У багатьох організмів окислювальне дезамінування може відбуватися за рахунок інших дегідрогеназ – оксидаз L-амінокислот або оксидаз D-амінокислот, коферментами яких є ФМН або ФАД (флавопротеїди).
Для оксидаз L-амінокислот реакція проходить за схемою:
(L) R–CHNH2–COOH + ФМН R–CO–COOH + NH3 + ФМНН2
-Кетокислота
для оксидаз D-амінокислот:
(D) R–CHNH2–COOH + ФАД R–CO–COOH + NH3 + ФАДН2
-Кетокислота
Біологічне значення оксидаз D-амінокислот полягає в тому, що вони виконують захисну роль, дезамінуючи D-амінокислоти бактеріального походження.
Відновлені флавіннуклеотиди можуть безпосередньо взаємодіяти з молекулярним киснем і утворювати пероксид водню, який є отрутою для клітини і тому розщеплюється каталазою на воду і кисень.
ФАДН2 + O2 ФАД + H2O2
Дегідрогеназа L-амінокислот (на відміну від дегідрогенази D-амінокислот) в тканинах тварин і рослин представлена слабо, і лише дегідрогеназа L-глутамінової кислоти проявляє себе виключно яскраво.
Тому допускають, що більшість L-амінокислот дезамінуються в організмі шляхом переамінування з α-кетоглутаровою кислотою за рівнянням:
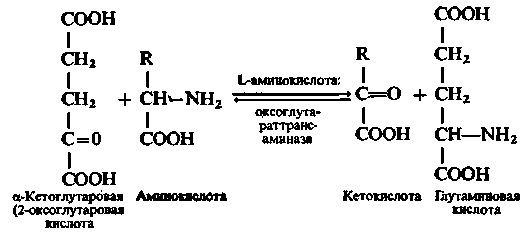
Далі глутамінова кислота зазнає окислювального дезамінування, а α-кетоглутарова кислота, що виділяється при цьому, знову залучається до реакції переамінування з α-амінокислотами.
Реакція переамінування між L-амінокислотами і α-кетоглутаровою кислотою обернена, тому за певних умов вона служить для синтезу L-амінокислот з кетокислот і глутамінової кислоти.
1.2.2. Відновне дезамінування.
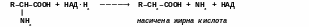
1 .2.3. Гідролітичне дезамінування.
1.2.4. Внутрішньомолекулярне переамінування.
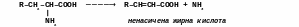
Головним продуктом дезамінування амінокислот є α-кетокислоти. Лише у деяких, особливих випадках кінцевими продуктами дезамінування амінокислот є насичені або ненасичені жирні кислоти, а також оксикислоти.
Дезамінування деяких амінокислот відбувається особливим чином, так:
сірковмісні амінокислоти (цистеїн і метіонін) дезамінуються шляхом відщеплення аміаку і сірководню або метилмеркаптану (CH3SH) відповідно;
оксиамінокислоти (серин і треонін) — шляхом відщеплення аміаку і води;
гетероциклічні амінокислоти — шляхом дегідрування по кільцю (пролін) з подальшим перетворенням продукту дегідрування і так далі.
Проте і в цих випадках кінцевими продуктами дезамінування залишаються кетокислоти і ненасичені жирні кислоти.
