
- •Кінетика ферментативних реакцій
- •Визначення активності ферментів.
- •Властивості ферментів
- •Утворення фермент-субстратного комплексу згідно теорії е.Фішера «ключ-замок»
- •Залежність швидкості ферментативної реакції від концентрації субстрату при постійній концентрації ферменту
- •Загальна схема інгібування ферменту
- •Оборотне інгібування.
- •Конкурентне інгібування.
- •Безконкурентне інгібування.
- •Інгібування субстратом.
Залежність швидкості ферментативної реакції від концентрації субстрату при постійній концентрації ферменту
Вплив активаторів та інгібіторів.
Речовини, що змінюють швидкість ферментативного каталізу і регулюють за рахунок цього метаболічні процеси, називаються ферментативними ефекторами. Ферментативні ефектори поділяють на активатори та інгібітори ферментів.
Активатори, це речовини, що збільшують швидкість ферментативної реакції. Активаторами можуть бути кислоти, мінеральні солі, органічні речовини (глутатіон), іони металів. Так, соляна кислота активізує дію пепсину, жовчні кислоти - панкреатичної ліпази. Дуже часто як активатори виступають іони металів (магній, марганець, калій, цинк тощо).
В ряді випадків активатори ферментів можуть:
виступати як складові компоненти активного центру ферментів, сприяючи утворенню фермент-субстратного комплексу;
утворювати з субстратом комплекс, який більш активно з’єднується з активним центром ферменту;
сприяти приєднанню коферменту до апоферменту;
забезпечувати становлення четвертинної структури ферменту;
в деяких випадках активатори взаємодіючи з ферментами, що має четвертинну структуру, роз’єднують їх субодиниці і тим самим відкривають доступ субстрату до активного центру ферменту;
інші можуть захищати молекули ферменту від інактивуючої дії різних факторів.
Як з'ясовано останнім часом, потужну дію на ферменти справляють алостеричні активатори. Вони приєднуються до алостеричного центру ферменту і змінюють третинну структуру білкової молекули. В результаті цього активний центр ферменту набуває найбільш вигідної для здійснення своїх функцій конфігурації.
Ферментативний інгібітор — речовина, що уповільнює протікання ферментативної реакції.
Вивчення інгібування ферментів відіграє важливу роль в створенні ліків, у вивченні механізму дії і структури ферментів.
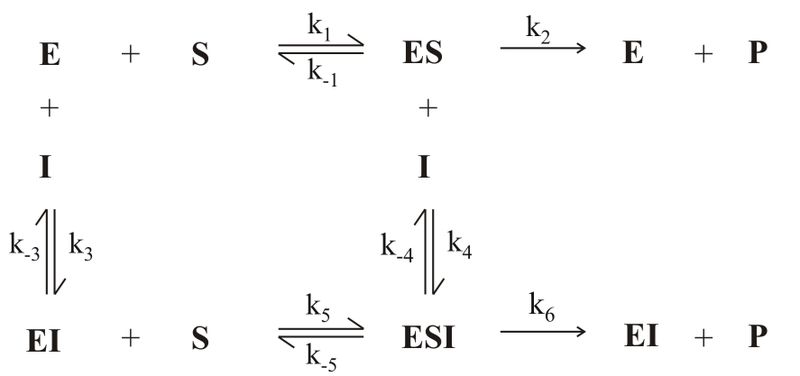
Загальна схема інгібування ферменту
Ферментативні інгібітори поділяють на дві групи:
специфічні – інгібітори, що здатні до специфічної взаємодії з функціональними центрами ферментів;
неспецифічні – різні неспецифічні фізичні,фізико-хімічні та хімічні впливи, що викликають денатурацію ферменту (висока температура, різні види опромінення, дія сильних кислот та лугів).
Специфічні інгібітори поділяють на оборотні ті необоротні:
необоротні інгібітори міцно з’єднуються з ферментом ковалентними зв’язками, викликаючи стійкі зміни функціональних груп ферменту в результаті чого він інактивується;
оборотні інгібітори зв’язуються з ферментом слабкими не ковалентними зв’язками іза певних умов можуть від нього відділятися.
Необоротне інгібування.
Необоротне інгібування супроводжується руйнуванням або модифікацією однієї або кількох функціональних груп активного центру ферменту. Необоротне інгібування ферментативних реакцій характеризується утворенням міцної сполуки ЕІ (фермент-інгібіторний комплекс), яка далі не розщеплюється: Е + І –> ЕІ. Утворення комплексу ЕІ найчастіше обумовлене виникненням ковалентних зв’язків з функціональними групами амінокислот, які беруть участь у каталітичному процесі (входять до складу активного центру).
Формування стабільного комплексу інгібітору з ферментом веде до його безповоротної інактивації. Необоротне інгібування можна виявити за тією ознакою, що при розбавленні розчину не відбувається підвищення питомої активності ферменту, як в разі оборотного інгібування
Наприклад, деякі ферменти повністю інгібуються дуже малими концентраціями іонів важких металів (ртуть, срібло, миш’як, іодоцтова кислота). Вони необоротно з’єднуються з сульфгідрильними групами і викликають осадження білку.
