
- •Кінетика ферментативних реакцій
- •Визначення активності ферментів.
- •Властивості ферментів
- •Утворення фермент-субстратного комплексу згідно теорії е.Фішера «ключ-замок»
- •Залежність швидкості ферментативної реакції від концентрації субстрату при постійній концентрації ферменту
- •Загальна схема інгібування ферменту
- •Оборотне інгібування.
- •Конкурентне інгібування.
- •Безконкурентне інгібування.
- •Інгібування субстратом.
Утворення фермент-субстратного комплексу згідно теорії е.Фішера «ключ-замок»
Нову інтерпретацію цієї гіпотези запропонував у 1959 р. Д.Кошланд. На основі даних, що дозволяють вважати активні центри фізично більш пластичними, він вважав, що можлива динамічна взаємодія між ферментом і субстратом. Згідно цьому уявленню, субстрат, з’єднуючись з ферментом, викликає і якістну зміну в структурі останнього. Амінокислотні залишки, що складають активний центр, приймають певну форму, яка дає можливість ферменту найбільш ефективно виконати свою функцію. Цю гіпотезу називають гіпотезою індукованої відповідності або “руки і перчатки”. Аналогією може слугувати перчатка, яка при одяганні на руку змінює свою форму.
6. Лабільність дії ферментів - залежність активності ферментів від температури, рН, концентрації субстрату і ферменту, вологості, окисно-відновного потенціалу, наявності активаторів та інгібіторів.
Вплив температури.
Ш видкість
ферментативної реакції підвищується
в два рази при підвищенні температури
на кожні 100С
в межах 0–40 0С.
З підвищенням температури рух молекул
прискорюється, і у молекул реагуючих
речовин виявляється більше шансів
зіштовхнутись один з одним. Збільшується,
відповідно, і імовірність того, що
реакція між ними відбудеться. Температура,
що забезпечує найбільшу активність,
називається оптимальною.
За межами цього рівня швидкість
ферментативної реакції знижується
внаслідок руйнації вторинної та третинної
структур ферменту, тобто внаслідок
денатурації.
видкість
ферментативної реакції підвищується
в два рази при підвищенні температури
на кожні 100С
в межах 0–40 0С.
З підвищенням температури рух молекул
прискорюється, і у молекул реагуючих
речовин виявляється більше шансів
зіштовхнутись один з одним. Збільшується,
відповідно, і імовірність того, що
реакція між ними відбудеться. Температура,
що забезпечує найбільшу активність,
називається оптимальною.
За межами цього рівня швидкість
ферментативної реакції знижується
внаслідок руйнації вторинної та третинної
структур ферменту, тобто внаслідок
денатурації.
Крім того, температура впливає на теплоту іонізації, і відповідно на стан іонізації всіх компонентів реакції – Е, S, ES.
При 800С майже всі ферменти втрачають свою активність (виключенням є фермент м’язової тканини - міокіназа, яка витримує нагрівання до 1000С).
Коли температура наближається до точки замерзання, ферменти інактивуються, але денатурація при цьому не відбувається. З підвищенням температури, їх каталітична активність знову відновлюється.
Оптимальною температурою для ферментів тваринного походження є 37 - 500С, рослинного - 40 - 600С.
Вплив рН середовища.
Оптимальне значення рН - при якому швидкість ферментативної реакції максимальна. Для різних ферментів ця величина дуже відрізняється, але, в основному, лежить в нейтральних межах. Виключенням є пепсин (рНопт = 2), тому що він входить до складу шлункового соку, що містить вільну соляну кислоту, яка створює оптимальне кисле середовище для дії цього ферменту; аргіназа (рНопт = 10).
В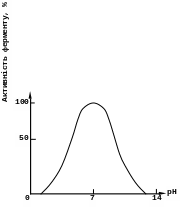 ідхилення
значення рН середовища змінює заряд
іонізованих кислотних та основних груп,
від якого залежить специфічна форма
молекул ферменту. В результаті змінюється
форма молекул ферменту, і, в першу чергу,
його активного центру, що впливає на
формування фермент-субстратного
комплексу. При дуже різких змінах рН
фермент денатурує.
ідхилення
значення рН середовища змінює заряд
іонізованих кислотних та основних груп,
від якого залежить специфічна форма
молекул ферменту. В результаті змінюється
форма молекул ферменту, і, в першу чергу,
його активного центру, що впливає на
формування фермент-субстратного
комплексу. При дуже різких змінах рН
фермент денатурує.
Вплив концентрації ферменту.
При високій концентрації субстрату і при незмінності інших факторів (температура, рН), швидкість ферментативної реакції пропорційна концентрації фермента.

Вплив концентрації субстрату.
При даній концентрації ферменту швидкість ферментативної реакції збільшується із підвищенням концентрації субстрату, але наступає момент, коли наступне збільшення концентрації субстрату не впливає на зростання швидкості, оскільки при високих концентраціях субстрату активні центри молекул ферменту в будь-який даний момент виявляються практично насиченими. Таким чином, скільки б не було надлишкового субстрату, він з’єднається з ферментом лише тоді, коли утворений раніше фермент-субстратний комплекс дисоціює на продукт та вільний фермент.
