
- •Контрольная работа
- •Методы анализа.
- •1.Органолептические показатели.
- •2.Физико-химические показатели.
- •Определение массовой доли общей золы термогравиметрическим методом в мармеладе:
- •Общая характеристика йодометрического титрования.
- •Закон Эквивалентов:
- •3.Показатели безопасности.
- •Атомно-абсорбционная спектроскопия.
- •4.Микробиологические показатели.
Определение массовой доли общей золы термогравиметрическим методом в мармеладе:
Метод основан на сжигание органических веществ в мармеладе.
Массовую долю общей золы (X) в процентах вычисляют по формуле:
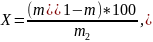
где - масса тиля, г;
- масса тигля с остатком после сжигания навески и прокаливания, г;
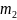 -
масса навески продукта, г.
-
масса навески продукта, г.
За окончательный результат анализа принимают среднеарифметическое результатов двух параллельных определений, допускаемое расхождение между которыми не должно превышать 0,03%.
Общая характеристика йодометрического титрования.
Титрование – это постепенное прибавление титрованного раствора реагента (титранта) к анализируемому раствору для определения точки эквивалентности. Титриметрический метод анализа основан на измерении объема реагента точно известной концентрации, затраченного на реакцию взаимодействия с определяемым веществом. Что позволяет нам рассчитать закон Эквивалентов.
Закон Эквивалентов:
Если два раствора взаимодействуют между собой в эквивалентных количествах, то зная концентрацию одного из растворов и прореагировавшие объемы обоих растворов, можно рассчитать неизвестную концентрацию второго раствора по соотношению:
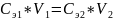
Йодометрический метод. В основе метода лежит реакция взаимодействия йодид- ионов с окислителем Ox с образованием йода и восстановителей Red:

Йодид-ион – довольно эффективный восстановитель. Однако растворы йодида непосредственно не применяются в качестве титранта, так как они не устойчивы и окисляются кислородом воздуха.
На практике к анализируемому раствору определяемого окислителя прибавляют избыток йодида калия. Йод, выделяющийся в качестве заместителя в количестве, эквивалентно количеству вступившего в реакцию окислителя Ox, оттитровывают стандартным раствором тиосульфата натрия:

Количество израсходованного титранта ‒ раствор тиосульфата натрия‒ эквивалентно количеству образовавшегося йода и следовательно, количеству определяемого окислителя Ox, провзаимодействовавшего с йодид-ионами.
Йодометрический метод имеет ряд преимуществ: точность по сравнению с другими методами окислительно-восстановительного титрования; растворы йода окрашены, и титрование можно проводить без индикатора; йод хорошо растворяется в органических растворителях, поэтому метод широко применяется для титрования в неводных средах.
Есть и ряд минусов этого метода: Относительно медленная скорость с участием йода и он легко летучие вещество и легко взаимодействует с воздухом (во избежание погрешностей в эксперименте используют специальную посуду и проведят титрования в холодных условиях), применяют в качестве индикатора крахмала, что делает йод менее чувствительным к повышению температуры. Йодометрическое титрование нельзя проводить в щелочной среде вследствие того что при pH >9 протекает побочная реакция, вызывающая диспропорционирования йода.
В процессе хранения стандартные растворы йода и тиосульфата изменяют свой титр. Чтобы избежать ошибок, необходимо периодически проверять титр йода по тиосульфату, а титр тиосульфата по дихромату калия.
Определение массовой доли редуцирующих веществ (сахара до инверсии):
Навеску измельченного мармелада берут, так чтобы количество редуцирующих веществ в 1см3 раствора навески было около 0,005 г.
Массу
навески )
в граммах вычисляют по формуле:
)
в граммах вычисляют по формуле:
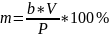 ,
,
где b- оптимальная концентрация редуцирующих веществ раствора навески, г/см3;
V- вместимость мерной колбы, см3;
P- предполагаемая массовая доля редуцирующих веществ в исследуемом изделии, %.
Кислотно-основное титрование (протолитометрия)-это экспериментальная методика определения концентрации кислоты либо основания, используется преимущественно количественном анализе. Метод основан на взаимодействие между кислотой и основанием, точнее –ионами гидроксония и гидроксида. Если рабочим раствором (титрантом) является раствор кислоты ,то метод называют ацидиметрией (от лат. Acidus- кислый), если же раствор сильного основания, то –алкалиметрией ( от лат. Alkali –щелочь)
Определение общей кислотности кислотно-основным титрованием в мармеладе:
Метод основан на нейтрализации кислоты, содержащейся в навеске, гидроокисью натрия (гидроокисью калия) в присутствии фенолфталеина до появления розовой окраски.
Кислотность (X) в градусах вычисляют по формуле:
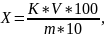
где K - поправочный коэффициент раствора гидроокиси натрия или калия концентрации (NaOH или КОН)=0,1 моль/дм, используемого для титрования; V- объем раствора гидроокиси натрия или калия, израсходованный на титрование, см; m - масса навески продукта, г;
100 - коэффициент пересчета на 100 г продукта;
10 - коэффициент пересчета раствора гидроокиси натрия или калия концентрации 0,1 моль/дм в 1 моль/дм3.
.
