
- •1.Загальна характеристика харчових технологій. Проаналізувати проблеми, які стоять перед харчовими виробництвами.
- •2.Обгрунтувати мету і результати настоювання сусла із мезгою білих і червоних сортів винограду.
- •3.Проаналізувати процеси, які відбуваються під час визрівання вина.
- •1 .Основні закономірності харчових технологій. Проаналізувати кінетику технологічних процесів.
- •2.Проаналізувати ферментативні гідролітичні процеси в суслі до початку бродіння.
- •3.Обгрунтувати необхідність і способи сульфітації сусла та м'язги у виноробстві. Техніка безпеки під час сульфітації сусла та мезги.
- •1 .Гідрогенізація жирів. Умови проведення та мета процесу.
- •2.Будова і склад виноградного грона.
- •1 .Проаналізувати особливості виявлення дії законів фундаментальних наук у харчових технологіях.
- •2.Обгрунтувати вплив фенольних сполук на смак і забарвлення молодих і витриманих вин.
- •3.Проаналізувати роботу обладнання для освітлення сусла методом відстоювання періодичної га безперервної дії.
- •1 .Хімізм спиртового бродіння.
- •2.Проаналізувати характеристики та особливості складу білих, рожевих і червоних столових вин
- •3.Охорона навколишнього середовища на підприємствах харчової промисловості. Роль сарчових підприємств у поліпшенні економічної обстановки в Україні.
- •1 .Основні складові харчових продуктів. Ліпіди, будова ліпідів і їх перетворення при зберіганні і технологічній обробці.
- •2.Запропонувати схему обробки вин, схильних до мікробіальнихпомутнінь і захворювань. Збгрунтувати її.
- •1.Очищення і рафінація рідинних напівфабрикатів в харчових технологіях (відстоювання, фільтрація, центрифугування і сепарація, мембранні методи).
- •2.Проаналізувати дію пліснявих грибів на якість винограду і вина на прикладі Ботрітіс цінереа
- •3.Обгрунтувати технологію та обладнання і пристрої для освітлення вин методом оклеювання.
- •1.Технологія крохмалю. Сировина, що використовується у виробництві. Основні стадії іиробництва картопляного крохмалю, вимоги якості.
- •2.Проаналізувати процеси, які відбуваються при формуванні вина.
- •Хімічний склад винограду, його зміни в процесі визрівання.
- •2.Дати оцінку приготуванню червоних столових вин за класичною технологією.
- •3.Технологія хліба. Приготування тіста із пшеничного борошна. Стисла технологія виробництва.
- •Требования к качеству хлеба
- •1.Технологія крупи. Вимоги до якості зерна, що переробляється на крупу. Принципова схема виробництва круп.
- •2.Обгрунтувати можливі шляхи зниження кислотності вина (сусла) в залежності від складу кислот.
- •2.Технологія борошна. Принципова схема виробництва борошна. Асортимент борошна,що виробляється в Україні і його якість.
- •3.Обгрунтувати технологічні процеси обробки м'язги та сусла ферментними препаратами.
- •1 .Фізико-хімічні основи харчових технологій. Екстрагування у виробництві харчових продуктів на прикладі виробництва соняшникової олії.
- •2.Технологія крохмальної патоки, види патоки. Принципова схема виробництва патоки кислотним способом.
- •3.Проаналізувати способи і обладнання при спиртуванні вин різного типу.
- •1.Набухання високомолекулярних сполук. Драглі. Розчинність полімерів. Проаналізувати ці явища у харчових виробництвах.
- •2.Хімічні методи очищення рослинних жирів.
- •3.В в яких випадках застосовується грубе та тонке фільтрування у виноробній промисловості. Яке обладнання та матеріали призначені для цього? Дати екологічну оцінку матеріалів для фільтрування.
- •1.Ферменти у харчових виробництвах. Роль ферментів на прикладі виробництва хліба.
- •2.Обгрунтуйте роль кисню в окислювально-відновних процесах, що відбуваються на різних етапах одержання вина.
- •.Технологія цукру, сульфітація, очищення дифузійного соку, виділення цукру.
- •I сатурация
- •2.Проаналізувати вплив температури, кислотності, вмісту спирту на життєдіяльність дріжджів.
- •3.Дати оцінку обладнанню та лініям для приготування малоокислених вин.
- •1.Технологія борошняних кондитерських виробів. Технологія печива.
- •2.Обгрунтувати вплив механічних операцій на кількість фенольних, ароматичних, азотистих та інших речовин, які переходять в сусло в процесі утворення вина.
- •3.Проаналізувати способи встановлення розливостійкості вин та їх якості перед розливанням.
- •1.Основні складові харчових продуктів. Вітаміни. Охарактеризувати їх перетворення при технологічній обробці.
- •2.Дати технологічну характеристику винних дріжджів.
- •3.Проаналізувати роль центрифуг для освітлення основних та вторинних продуктів виноробства.
- •1.Структурно-механічні властивості харчових мас. Основні поняття реології. Реологічні моделі та рівняння. Проаналізувати їх використання у харчових технологіях.
- •2.Обгрунтувати засоби попередження і усунення дріжджових помутнінь в вині.
- •3.Обгрунтувати особливості технології ігристих вин.
- •1.Основні закономірності харчових технологій. Хімічна кінетика. Охарактеризувати кінетику реакцій різних типів. Навести приклад аналогічних процесів у харчовому виробництві.
- •2.Запропонувати і обгрунтувати схему обробки вин, схильних до оксидазного касу.
- •3.Обгрунтувати необхідність купажування, способи та обладнання для купажування та асамбляжу виноматеріалу.
- •1.Характеристика технології як науки. Проаналізувати етапи розвитку технології.
- •2.Проаналізувати ферментативні окислювально-відновні процеси в суслі і мезгі.
- •3.Проаналізувати сучасну техніку і технологію виробництва коньяку.
- •1 .Особливості виробництва харчових продуктів. Проаналізувати вплив складу сировини на якість готової продукції.
- •2.Технологія жирів. Харчові рослинні жири, як сировина для виробництва продовольчих товарів. Властивості і оцінка якості жирів.
- •3.Яке обладнання краще застосовувати для отримання міцних ординарних та марочних червоних десертних вин.
- •1.Основні складові харчових продуктів. Білки. Будова білків. Проаналізувати їх перетворення при технологічній обробці.
- •2.Вода як сировина в харчових виробництвах. Основні методи підготовки води.
- •3.Проаналізувати умови вирощування винограду для виробництва різних виноматеріалів.
- •1.Термічна обробка сировини в харчових технологіях. Мета і методи обробки.
- •2.Технологія глюкози. Основні стадії процесу. Оцінка якості глюкози.
- •3.Обгрунтувати основні вимоги до сучасної технології і обладнання по виробництву виноградних вин.
- •1.Основні складові харчових продуктів. Моносахариди і полісахариди. Проаналізувати їх перетворення при технологічній обробці.
- •2.Технологія пива. Основна сировина. Вимоги до якості пива.
- •Оценка качества пива
- •3.Проаналізувати способи транспортування винограду на переробку, їх вплив наякість вина.
- •1 .Емульсії у харчових виробництвах на прикладі виробництва майонезу.
- •2.Обгрунтувати застосування дисперсних мінералів для освітлення вин.
- •3.Обгрунтувати різницю технологічних операцій при переробці винограду на сусло для білих столових, міцних та десертних вин.
- •1 .Класифікація харчових виробництв. Проаналізувати місце виноробної промисловості за цією класифікацією.
- •2.Технологія хліба. Асортимент хлібобулочних виробів. Особливості технології пшеничного і житнього хліба. Хлібопекарські властивості борошна.
- •Властивості пшеничного і житнього хліба
- •3.Обгрунтувати необхідність відокремлення ягід від гребенів та його практичне здійснення за допомогою пристроїв.
- •1.Основні закономірності процесу дифузії на прикладі цукрового виробництва.
- •2. Запропонувати схеми обробки вин, схильних до кристалічних помутнінь. Обгрунтувати їх.
- •1.Основні стадії очищення дифузійного соку у цукровому виробництві.
- •2.Проаналізувати шляхи зв'язування металів в виноматеріалах. Дати екологічну оцінку речовин, які використовують для деметалізації вин
- •3.Методи контролю спиртового бродіння та визначення моменту і способів зняття вина із дріжджів і мезги.
- •1 .Об'єкти, предмети та завдання харчової технології.
- •2.Технологія хліба. Приготування хліба з житнього борошна. Види заквасок, методи їх приготування.
- •3.Обгрунтувати необхідність обробки виноматеріалів і вин холодом.
- •1.Основні закономірності харчових технологій. Умови рівноваги системи. Проаналізувати умови рівноваги процесів харчових технологій.
- •2.Екстракція в харчових технологіях на прикладі отримання соняшникової олії. Техніка безпеки при виробництві соняшникової олії.
- •3.Проаналізувати процес і методи приготування розводки винних дріжджів із чистої культури.
3.Обгрунтувати необхідність обробки виноматеріалів і вин холодом.
Обробка вин холодом застосовується для надання їм стабільності. Така стабільність досягається за рахунок виділення в осад при знижених температурах складових речовин вина - тартратів, фенольних і азотистих з'єднань, полісахаридів, надлишковий вміст яких може бути причиною помутніть.
Найбільш щадним і тим, що зберігає стабільність і поліпшує якість вина, є режим швидкого охолодження до -4 + -5°С, 2-добової витримки при температурі охолодження і наступним фільтруванням.
Температура і тривалість охолодження впливає на кількість тартратів, які видаляються з вина. Фенольні й азотисті речовини менш чуттєві до режиму обробки, і їхній надлишок може бути вилучений ретельним фільтруванням відразу ж після охолодження. Швидке охолодження, хоча і зумовлює швидку кристалізацію, але при цьому вино через наявність дрібних кристалів освітлюється гірше, кристали проходять через фільтрувальну перегородку, тому більш ефективним є повільне охолодження. Для збільшення швидкості кристалізації застосовують штучне створення центрів кристалізації внесенням в охолоджене вино так званої «затравки» - кристалів тартрату.
Білет ЗО
1.Основні закономірності харчових технологій. Умови рівноваги системи. Проаналізувати умови рівноваги процесів харчових технологій.
Химические реакции, которые когут протекать как в прямом, так и в обратном направлениях называютсяо братимыми:
А+В
(реагенты)
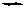 С+D (продукты)
С+D (продукты)
Из этого уравнения видно, что в реакционной смеси обратимой реакции осуществляется как взаимодействие реагентов с образованием продуктов, так и взаимодействие продуктов с образованием реагентов. В связи с этим различают прямую реакцию, протекающую по уравнению слева направо и обратную реакцию, протекающую по уравнению справа налево. Направление протекания реакции определяется условиями ее проведения (температурой, давлением, концентрацией веществ). Многие реакции имеют одно преимущественное направление и для проведения таких реакций в противоположном направлении требуются экстремальные условия. В подобных реакциях происходит почти полное превращение реагентов в продукты.
В химических реакциях, которые способны при заданных условиях протекать в обох направлениях, не происходит взаимодействия веществ без остатка. Прямая и обратная реакции проте кают одновременно в противоположных направлениях.
Зависимость между прямой и обратной реакцией количественно выражается через скорость реакции. Скорость химической реакции зависит от числа реагирующих (т.е. соударяющихся) частиц. В первый момент протекания обратимой реакции в системе содержатся только частицы исходных веществ, потому протекает только прямая реакция, причем с очень большой скоростью.
При появлении частиц конечных веществ развивается обратная реакция. По мере протекания прямой реакции накапливается все большее число частиц конечных веществ, которые принимают участие в обратной реакции, скорость которой также постепенно возрастает. Одновременно снижается число частиц исходных веществ, и скорость прямой реакции постепенно снижается. Со временем, в реакционной системе достигается состояние, при котором скорости прямой и обратной реакций становятся равны (см. рис. ). Такое состояние реакционной системы называется состоянием химического равновесия.
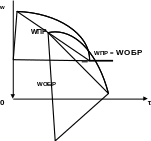
Рис.. Изменение во времени скорости прямой WПР и обратной WОБР реакций до достижения состояния равновесия.
При химическом равновесии обе реакции, как прямая, так и обратная продолжают протекать, следовательно, это равновесие динамическое, подвижное или как его еще называют квазистатическое.
Во всех обратимых реакциях скорость прямой реакции уменьшается, скорость обратной возрастает до тех пор, пока обе скорости не станут равными и не установится состояние равновесия.
К химическому равновесию применим второй закон термодинамики в его общем виде: одним из условий химического равновесия в изолированной системе является максимум энтропии. Дальнейшего приращения энтропии в состоянии равновесия не происходит, т.е. dS=0.
Положение химического равновесия зависит от следующих параметров реакции: температуры, давления, концентрации веществ. Влияние, которое оказывают эти факторы на химическую реакцию, подчиняются закономерности, которая была высказана Ле Шателье, подтверждена Вант-Гоффом и термодинамически обоснована Брауном. Поэтому эта закономерность называется принципом Ле Шателье – Вант-Гоффа – Брауна. Чаще всего кратко – принципом Ле Шателье, который в современной формулировке утверждает следующее: если на систему, находящуюся в состоянии равновесия, оказать внешнее воздействие, то система перейдет в другое состояние равновесия так, чтобы уменьшить эффект внешнего воздействия.
Влияние температуры: при повышении температуры химическое равновесие смещается в направлении эндотермической реакции; при понижении температуры – в сторону экзотермической реакции.
Влияние давления: при повышении давления равновесие сдвигается в направлении образования веществ (реагентов или продуктов) с меньшим объемом; при понижении давления равновесие сдвигается в направлении образования веществ (реагентов, продуктов) с большим объемом. Необходимо отметить, что равновесие под влиянием изменения давления смещается лишь в том случае, когда в реакции принимают участие газообразные вещества и реакции сопровождаются изменением общего числа молекул.
Влияние концентрации: при повышении концентрации одного из реагентов равновесие сдвигается в направлении образования продуктов реакции; при повышении концентрации одного из продуктов реакции равновесие сдвигается в направлении образования реагентов.
Количественное описание обратимых реакций можно проводить с помощью закона действующих масс. Применительно к простым гомогенным обратимым реакциям типа
А + В С + D,
в которой все стехиометрические коэффициенты равны 1, закон действующих масс формулируется так:
химическая реакция находится в равновесии, если соотношение произведений концентраций продуктов к произведению концентраций реагентов достигает постоянного значения, характерного для данной реакции при данной температуре:
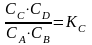
Если в уравнении химической реакции появляются стехиометрические коэффициенты:
mA + nB pC + qD
то выражение (11) в этом случае примет вид:
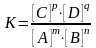 (13)
(13)
где К – константа равновесия;
Константа равновесия является количественной мерой этого состояния при данных температуре и давлении.
Чем выше константа равновесия, тем в большей степени в равновесной реакционной смеси преобладают продукты реакции; чем ниже константа равновесия, тем в большей степени в равновесной реакционной смеси преобладают реагенты.
