
- •1.Загальна характеристика харчових технологій. Проаналізувати проблеми, які стоять перед харчовими виробництвами.
- •2.Обгрунтувати мету і результати настоювання сусла із мезгою білих і червоних сортів винограду.
- •3.Проаналізувати процеси, які відбуваються під час визрівання вина.
- •1 .Основні закономірності харчових технологій. Проаналізувати кінетику технологічних процесів.
- •2.Проаналізувати ферментативні гідролітичні процеси в суслі до початку бродіння.
- •3.Обгрунтувати необхідність і способи сульфітації сусла та м'язги у виноробстві. Техніка безпеки під час сульфітації сусла та мезги.
- •1 .Гідрогенізація жирів. Умови проведення та мета процесу.
- •2.Будова і склад виноградного грона.
- •1 .Проаналізувати особливості виявлення дії законів фундаментальних наук у харчових технологіях.
- •2.Обгрунтувати вплив фенольних сполук на смак і забарвлення молодих і витриманих вин.
- •3.Проаналізувати роботу обладнання для освітлення сусла методом відстоювання періодичної га безперервної дії.
- •1 .Хімізм спиртового бродіння.
- •2.Проаналізувати характеристики та особливості складу білих, рожевих і червоних столових вин
- •3.Охорона навколишнього середовища на підприємствах харчової промисловості. Роль сарчових підприємств у поліпшенні економічної обстановки в Україні.
- •1 .Основні складові харчових продуктів. Ліпіди, будова ліпідів і їх перетворення при зберіганні і технологічній обробці.
- •2.Запропонувати схему обробки вин, схильних до мікробіальнихпомутнінь і захворювань. Збгрунтувати її.
- •1.Очищення і рафінація рідинних напівфабрикатів в харчових технологіях (відстоювання, фільтрація, центрифугування і сепарація, мембранні методи).
- •2.Проаналізувати дію пліснявих грибів на якість винограду і вина на прикладі Ботрітіс цінереа
- •3.Обгрунтувати технологію та обладнання і пристрої для освітлення вин методом оклеювання.
- •1.Технологія крохмалю. Сировина, що використовується у виробництві. Основні стадії іиробництва картопляного крохмалю, вимоги якості.
- •2.Проаналізувати процеси, які відбуваються при формуванні вина.
- •Хімічний склад винограду, його зміни в процесі визрівання.
- •2.Дати оцінку приготуванню червоних столових вин за класичною технологією.
- •3.Технологія хліба. Приготування тіста із пшеничного борошна. Стисла технологія виробництва.
- •Требования к качеству хлеба
- •1.Технологія крупи. Вимоги до якості зерна, що переробляється на крупу. Принципова схема виробництва круп.
- •2.Обгрунтувати можливі шляхи зниження кислотності вина (сусла) в залежності від складу кислот.
- •2.Технологія борошна. Принципова схема виробництва борошна. Асортимент борошна,що виробляється в Україні і його якість.
- •3.Обгрунтувати технологічні процеси обробки м'язги та сусла ферментними препаратами.
- •1 .Фізико-хімічні основи харчових технологій. Екстрагування у виробництві харчових продуктів на прикладі виробництва соняшникової олії.
- •2.Технологія крохмальної патоки, види патоки. Принципова схема виробництва патоки кислотним способом.
- •3.Проаналізувати способи і обладнання при спиртуванні вин різного типу.
- •1.Набухання високомолекулярних сполук. Драглі. Розчинність полімерів. Проаналізувати ці явища у харчових виробництвах.
- •2.Хімічні методи очищення рослинних жирів.
- •3.В в яких випадках застосовується грубе та тонке фільтрування у виноробній промисловості. Яке обладнання та матеріали призначені для цього? Дати екологічну оцінку матеріалів для фільтрування.
- •1.Ферменти у харчових виробництвах. Роль ферментів на прикладі виробництва хліба.
- •2.Обгрунтуйте роль кисню в окислювально-відновних процесах, що відбуваються на різних етапах одержання вина.
- •.Технологія цукру, сульфітація, очищення дифузійного соку, виділення цукру.
- •I сатурация
- •2.Проаналізувати вплив температури, кислотності, вмісту спирту на життєдіяльність дріжджів.
- •3.Дати оцінку обладнанню та лініям для приготування малоокислених вин.
- •1.Технологія борошняних кондитерських виробів. Технологія печива.
- •2.Обгрунтувати вплив механічних операцій на кількість фенольних, ароматичних, азотистих та інших речовин, які переходять в сусло в процесі утворення вина.
- •3.Проаналізувати способи встановлення розливостійкості вин та їх якості перед розливанням.
- •1.Основні складові харчових продуктів. Вітаміни. Охарактеризувати їх перетворення при технологічній обробці.
- •2.Дати технологічну характеристику винних дріжджів.
- •3.Проаналізувати роль центрифуг для освітлення основних та вторинних продуктів виноробства.
- •1.Структурно-механічні властивості харчових мас. Основні поняття реології. Реологічні моделі та рівняння. Проаналізувати їх використання у харчових технологіях.
- •2.Обгрунтувати засоби попередження і усунення дріжджових помутнінь в вині.
- •3.Обгрунтувати особливості технології ігристих вин.
- •1.Основні закономірності харчових технологій. Хімічна кінетика. Охарактеризувати кінетику реакцій різних типів. Навести приклад аналогічних процесів у харчовому виробництві.
- •2.Запропонувати і обгрунтувати схему обробки вин, схильних до оксидазного касу.
- •3.Обгрунтувати необхідність купажування, способи та обладнання для купажування та асамбляжу виноматеріалу.
- •1.Характеристика технології як науки. Проаналізувати етапи розвитку технології.
- •2.Проаналізувати ферментативні окислювально-відновні процеси в суслі і мезгі.
- •3.Проаналізувати сучасну техніку і технологію виробництва коньяку.
- •1 .Особливості виробництва харчових продуктів. Проаналізувати вплив складу сировини на якість готової продукції.
- •2.Технологія жирів. Харчові рослинні жири, як сировина для виробництва продовольчих товарів. Властивості і оцінка якості жирів.
- •3.Яке обладнання краще застосовувати для отримання міцних ординарних та марочних червоних десертних вин.
- •1.Основні складові харчових продуктів. Білки. Будова білків. Проаналізувати їх перетворення при технологічній обробці.
- •2.Вода як сировина в харчових виробництвах. Основні методи підготовки води.
- •3.Проаналізувати умови вирощування винограду для виробництва різних виноматеріалів.
- •1.Термічна обробка сировини в харчових технологіях. Мета і методи обробки.
- •2.Технологія глюкози. Основні стадії процесу. Оцінка якості глюкози.
- •3.Обгрунтувати основні вимоги до сучасної технології і обладнання по виробництву виноградних вин.
- •1.Основні складові харчових продуктів. Моносахариди і полісахариди. Проаналізувати їх перетворення при технологічній обробці.
- •2.Технологія пива. Основна сировина. Вимоги до якості пива.
- •Оценка качества пива
- •3.Проаналізувати способи транспортування винограду на переробку, їх вплив наякість вина.
- •1 .Емульсії у харчових виробництвах на прикладі виробництва майонезу.
- •2.Обгрунтувати застосування дисперсних мінералів для освітлення вин.
- •3.Обгрунтувати різницю технологічних операцій при переробці винограду на сусло для білих столових, міцних та десертних вин.
- •1 .Класифікація харчових виробництв. Проаналізувати місце виноробної промисловості за цією класифікацією.
- •2.Технологія хліба. Асортимент хлібобулочних виробів. Особливості технології пшеничного і житнього хліба. Хлібопекарські властивості борошна.
- •Властивості пшеничного і житнього хліба
- •3.Обгрунтувати необхідність відокремлення ягід від гребенів та його практичне здійснення за допомогою пристроїв.
- •1.Основні закономірності процесу дифузії на прикладі цукрового виробництва.
- •2. Запропонувати схеми обробки вин, схильних до кристалічних помутнінь. Обгрунтувати їх.
- •1.Основні стадії очищення дифузійного соку у цукровому виробництві.
- •2.Проаналізувати шляхи зв'язування металів в виноматеріалах. Дати екологічну оцінку речовин, які використовують для деметалізації вин
- •3.Методи контролю спиртового бродіння та визначення моменту і способів зняття вина із дріжджів і мезги.
- •1 .Об'єкти, предмети та завдання харчової технології.
- •2.Технологія хліба. Приготування хліба з житнього борошна. Види заквасок, методи їх приготування.
- •3.Обгрунтувати необхідність обробки виноматеріалів і вин холодом.
- •1.Основні закономірності харчових технологій. Умови рівноваги системи. Проаналізувати умови рівноваги процесів харчових технологій.
- •2.Екстракція в харчових технологіях на прикладі отримання соняшникової олії. Техніка безпеки при виробництві соняшникової олії.
- •3.Проаналізувати процес і методи приготування розводки винних дріжджів із чистої культури.
2.Обгрунтувати засоби попередження і усунення дріжджових помутнінь в вині.
Біологічні помутніння відбуваються в зв'язку з розвитком у вині мікроорганізмів - дріжджів, дріжджеподібних грибків.
До біологічних помутнінь відносяться помутніння ферментативного характеру (бурий кас), зв'язані з присутністю в соку винограду та у вині окисних ферментів. Біологічні помутніння найчастіше з'являються в столових сухих і напівсолодких винах. До біологічних помутнінь відносяться також помутніння, викликувані діяльністю хвороботворних мікроорганізмів. Такими хворобами, як уже відзначалося, є оцтовокисле і молочнокисле скисання, цвіль вина, ожиріння, згіркнення, маннітне бродіння. Виникненню і розвитку біологічних помутнінь сприяють вміст залишкового цукру і легкозасвоюваних азотистих речовин, доступ до вина кисню повітря, наявність у вині активних винних і плівчастих дріжджів. Діагностують біологічні помутніння звичайно прямим мікроскопуванням проби вина.
Біологічні помутніння зумовлені розвитком в вині мікроорганізмів - дріжджів бактерій. Дріжджові помутніння викликають як винні, так і плівчасті дріжджі.
До дріжджових помутнінь, які викликаються винними дріжджами, схильні столові вина з залишковим сахаром вище 0,2 г/дм3, напівсолодкі і десертні вина. таких винах дріжджі розмножуються, зброджують залишковий сахар і на дні пляшки утворюють осад, а при підвищенні тиску в пляшках з них вилітають пробки.
До дріжджових помутнінь, які викликаються плівчастими дріжджами, схильї легкі столові вина, на поверхні яких в пляшках утворюється плівка (цвіль вина).
Причинами дріжджових помутнінь є наявність в вині активних дріжджовії клітин, сахарів, кисню і підвищена температура на складах і в магазинах.
3.Обгрунтувати особливості технології ігристих вин.
Насичення вин двооксидом вуглецю використовується при виготовленні шампанського, ігристих і газованих вин, а також іскристих (перлових) і деяких типів столових вин.
Насичення двооксидом вуглецю при одержанні шампанського, ігристих і іскристих вин проводять вторинним бродінням з доданою сахарозою (тиск при 20°С в готових ігристих винах і шампансь-<ому 300-400 КПа, в іскристих і газованих винах - 200 КПа)
Деякі типи столових вин насичують СОг до вмісту 0,6 - 0,8 :;/дм2 шляхом доброджування виноматеріалів (наприклад Мюскаде у Франції), яблучно-молочного бродіння («зелені» вина в Португалії) або сатурацією при розливі (сухі столові вина в Сицилії). Введення у вина двооксиду вуглецю забезпечує створення специфічних якостей, властивих ігристому і газованому винам, зберігає їх від зайвого окислювання, що сприяє збереженню сортового аромату, додає вину свіжість, визначену пікантність.
Білет 19
1.Основні закономірності харчових технологій. Хімічна кінетика. Охарактеризувати кінетику реакцій різних типів. Навести приклад аналогічних процесів у харчовому виробництві.
Кинетика единичных процессов пищевой технологии и 1учает закономерности изменения характеристик процесса (концентрации, температуры и пр.) во времени. , И основе ее лежит понятие о скорости процесса. Как наука кинетика связана с теорией дифференциальных уравнений, термодинамикой и статистической физикой.
Химическая кинетика изучает механизм, скорости, и закономерности протекания во времени химических процессов. Объект биологической кинетики — явления, происходящие в живой природе. В ней различают четыре направления: биохимическую, биофизическую, микробиологическую и популяционную кинетику. Для пищевых производств наибольшее значение имеет биохимическая кинетика, изучающая скорости биохимических реакций, методы которой позволяют установить механизм ферментативного катализа.
Химическая кинетика. Скорость химической реакции определяется числом молекул, реагирующих в единицу времени. Чтобы сравнить скорость различных реакций, число молекул относят к единице объема. Таким образом, скорость реакции характеризуется числом молекул или молей данного вещества, реагирующих в единицу времени в единице объема. Если в объеме V находится п молей вещества А, то концентрация с = п/V, а скорость реакции
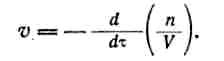
Формально скорость реакции можно определить как производную концентрации реагирующего вещества по времени, взятую со знаком минус, который означает, что в ходе реакции концентрация реагентов убывает.
Если реакция протекает в изохорических условиях
![]()
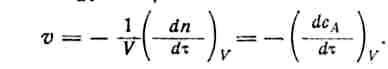
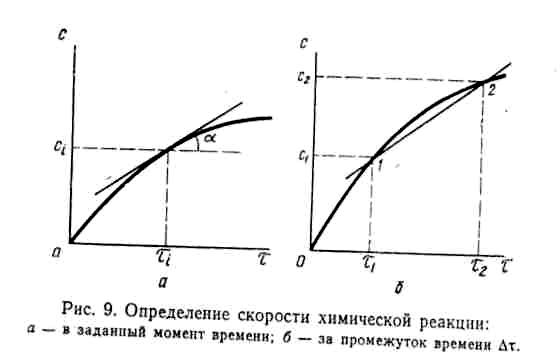
![]()
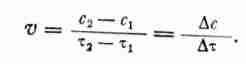
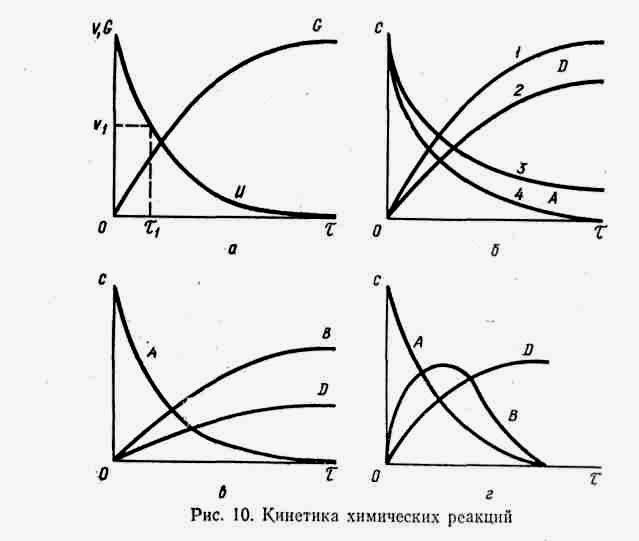
Закон действующих масс — основной закон химической кинетики, в соответствии с которым в самом общем случае скорость химической реакции V прямо пропорциональна концентрациям реагирующих веществ в некоторых степенях:
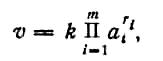
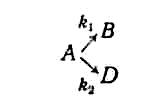
Во многих производствах технологии органических веществ целевыми являются промежуточные продукты реакции. Как видно из рис. 10, г, для оптимального выхода продукта В необходимо не только большее соотношение кг/я*, но и оптимальное время процесса. С увеличением этого времени происходит дальнейшее превращение целевого продукта В, что нежелательно. Такие реакции, в частности, наблюдаются при окислительных процессах, используемых в пищевой технологии при производстве спиртов, альдегидов, кислот и других кислородных производных органических соединений, а также в процессах неполного гидрирования.
