- •1.Биохимия, её задачи. Значение биохимия для медицины.
- •Задачи биохимии:
- •Значение биохимии для медицины.
- •2.Аминокислоты, их классификация. Строение и биологическая роль аминокислот.
- •Строение:
- •Функции аминокислот:
- •3.Строение белков. Уровни структурной организации белка. Характеристика связей, стабилизирующих их. Доменные белки.
- •Структурная организация белков.
- •4.Электро-химические свойства белков как основа методов их исследования. Электрофорез белков крови.
- •5.Коллоидные свойства белков. Гидратация. Растворимость. Денатурация, роль шаперонов.
- •Гидратация
- •Растворимость
- •6. Принципы классификации белков. Простые и сложные белки. Характеристика простых белков: гистоны, протамины, альбумины, глобулины.
- •Простые белки.
- •7.Современные представления о структуре и функциях нуклеиновых кислот. Первичная и вторичная структуры днк. Строение мономеров нуклеиновых кислот. Нуклеопротеины. Методы исследования днк (пцр).
- •Первичная структура днк.
- •Вторичная структура днк.
- •Нуклеопротеины
- •Полимеразная цепная реакция.
- •8. Хромопротеины. Строение и функции гемоглобина. Типы гемоглобина. Миоглобин.
- •Гемоглобин.
- •9. Липид-белковые комплексы. Строение липидных компонентов. Структурные протеолипиды и липопротеины, их функции.
- •Свободные липопротеины
- •Структурные протеолипиды
- •10. Ферменты, их химическая природа, структурная организация. Активный центр ферментов, его свойства.
- •Строение ферментов.
- •11. Коферменты и их функции в ферментативных реакциях. Витаминные коферменты. Примеры реакций с участием витаминных коферментов. Тиаминовые коферменты, тдф.
- •Тиаминовые коферменты, тдф.
- •12. Никотинамидные коферменты. Структура над, надф. Примеры реакций.
- •13. Флавиновые коферменты. Структура фмн,фад. Примеры реакций.
- •14. Пиридоксиновые коферменты. Строение пф, примеры реакций.
- •15. Роль фолиевой кислоты и в12 в реакциях трансметилирования, s-аденозилметионин, его образование. Пример реакции с цчастием фолиевой кислоты и в12.
- •16. Свойства ферментов. Лабильность конформации, влияние температуры и pH среды. Специфичность действия ферментов, примеры реакций.
- •17. Номенклатура и классификация ферментов. Характеристика класса оксидоредуктаз, примеры реакций.
- •6 Классов:
- •18. Характеристика класса трансфераз и гидролаз. Примеры реакций.
- •19.Лиазы, изомеразы, лигазы. Характеристика, примеры реакций с участием ферментов этих классов.
- •20. Современные представления о механизме действия ферментов. Стадии ферментативного катализа, молекулярные эффекты, примеры.
- •21. Ингибирование ферментов. Конкурентное и неконкурентное ингибирование, примеры реакций. Лекарственные вещества, как ингибиторы ферментов.
- •22. Понятие об изоферментах. Характеристика изоферментов Лактатдегидрогеназы (лдг) и креатинкиназы (кк). Использование ферментов в медицине. Энзимодиагностика, энзимотерапия. Энзимопатология, примеры.
- •23. Обмен веществ и энергии. Этапы обмена веществ. Общий путь катаболизма. Окислительное декарбоксилирование пирувата.
- •Окислительное декарбоксилирование пвк
- •24. Цитратный цикл, химизм процесса, его биологическое значение.
- •25.Сопряжение реакций цикла цтк с дыхательной цепью ферментов.
- •По укороченной цепи фад→ фадн2
- •26. Современные представления о биологическом окислении. Первичные акцепторы водорода. Электронно-транспортная цепь.
- •Первичные акцепторы протонов и электроногв.
- •Электронно-транспортная цепь
- •27.Характеристика компонентов электрон-транспортной цепи
- •28. Пути синтеза атф. Субстратное фосфорилирование (пример). Молекулярные механизмы окислительного фосфорилирования (теория Митчелла). Разобщение окисления и фосфорилирования.
- •Механизм окислительного фосфорилирования
- •29. Альтернативные пути биологического окисления, оксигеназный путь. Микросомальные монооксигеназы.
- •30. Свободнорадикальное окисления. Токсичность кислорода. Активный формы кислорода. Антиокислительная защита. Роль сро в патологии.
- •31. Белки: роль, потребность, биологическая ценность. Строение незаменимых ак. Превращение белков в желудке, роль соляной кислоты. Действие пептид гидролаз. Анализ желудочного содержимого.
- •Переваривание белков
- •32.Превращение белков в желудке. Роль соляной кислоты в переваривании белков. Показать действие пепсина на конкретном примере.
- •33. Переваривание белков в кишечнике.
- •34. Гниение белков и аминокислот в кишечнике. Пути образования продуктов гниения. Примеры.
- •1.Декабоксилирование
- •35. Механизм обезвреживания продуктов гниения белков. Роль фафс и удф-гк.
- •36. Трансаминирование и декарбоксилирование аминокислот.
- •37. Декарбоксилирование аминокислот, образование биогенных аминов. Роль в этом процессе пф.
- •38. Реакции дезаминирования аминокислот.
- •1. Неокислительное
- •2. Внутримолекулярное:
- •39.Оринтиновый цикл.
- •40. Особенности катаболизма пуриновых нуклеотидов. Их строение и распад. Образование мочевой кислоты. Подагра.
- •41. Генетический код и его свойства.
- •Свойства:
- •42. Механизмы репликации днк. Условия необходимые для репликации. Основные этапы репликации.
- •Основы для репликации:
- •Условия репликации:
- •Этапы репликации:
- •43. Биосинтез рнк (транскрипция). Условия и этапы транскрипции.
- •Условия транскрипции:
- •Этапы Транскрипции:
- •44. Процессинг рнк. Альтернативный сплайсинг.
- •45.Биосинтез белка. Белково-синтетический ферментативный комплекс.
- •Белковые факторы:
- •46. Этапы трансляции и их характеристика.
- •47. Посттрансляционный процессинг. Виды химической модификации, фолдинг, роль шаперонов.
- •48. Строение оперона. Регуляция биосинтеза белка у прокариотов. Функционирование лактозного и гистидинового оперонов.
- •Регуляция оперона по методу индукции.
- •Регуляция оперона по методу репрессии
- •49. Особенности и уровни регуляции биосинтеза белка у эукариотов. Амплификация генов, энхансерные и сайленсерные элементы.
- •1. На уровне генов:
- •6. Регуляция на уровне трансляции:
- •50. Современные представления о структурно-функциональной организации днк. Основные направления молекулярной биологии: геномика, транскриптомика, рн-омика, протеомика.
- •51. Ингибиторы белковых синтезов. Действие антибиотиков и токсинов. Биологическая роль теломер и теломераз.
- •Токсины
- •Теломеры и теломеразы. Их роль в развитии опухолевого роста.
- •52. Виды молекулярных мутаций и их биологические последствия.
- •1. Замена:
- •2. Вставка:
- •53. Биохимический полиморфизм и его биологическая роль. Непереносимость пищевых веществ и лекарств.
- •54. Основные углеводы, их строение и классификация, биологическая роль.
- •Гомополисахариды
- •Гетерополисахариды
- •55. Роль углеводов в питании. Переваривание и всасывание углеводов в органах пищеварительной системы. Написать реакции.
- •56. Катаболизм глюкозы в анаэробных условиях. Химизм процесса, биологическая роль.
- •57. Катаболизм глюкозы в тканях в аэробных условиях. Гексозодифосфатный путь превращения глюкозы и его биологическая роль. Эффект Пастера.
- •1. Этапы аэробного гликолиза
- •Эффект Пастера
- •58. Гексозомонофосфатный путь превращения глюкозы в тканях и его биологическая роль. Химизм реакций окислительной стадии.
- •1. Транскетолазные реакции:
- •2. Трансальдолазная реакция:
- •59. Биосинтез и распад гликогена в тканях. Биологическая роль этих процессов
- •Распад гликогена
- •1. Основной фосфоролитический путь
- •2.Неосновной амилолитический.
- •60. Глюконеогенез. Возможные предшественники, последовательность реакций, биологическая роль.
- •61.Характеристика основных липидов организма человека, их строение, классификация, суточная потребность и биологическая роль.
- •62. Эйкозаноиды - регуляторы обмена веществ; химическая природа, биологические эффекты эйкозаноидов.
- •1.Простагландины:
- •63.Биологическая роль липидов пищи. Переваривание, всасывание липидов в органах пищеварительной системы. Жёлчные кислоты. Их строение, биологическая роль
- •64. Характеристика липопротеинов крови, их биологическая роль.
- •65.Окисление высших жирных кислот в тканях. Химизм реакций, биологическая роль
- •66.Окисление глицерола. Химизм реакций, биологическая роль.
- •67. Биосинтез высших жирных кислот в тканях. Химизм реакций, биологическая роль.
- •68.Холестерол. Его химическое строение, биосинтез и биологическая роль.
- •69. Образование кетоновых тел в тканях. Биологическое значение кетоновых тел. Кетоацидоз.
- •70. Сигнальные молекулы, их классификация. Виды регуляторных эффектов сигнальных молекул. Понятие о клетке мишени.
- •Задачи:
- •Особенности сигнальных молекул:
- •Виды регуляторных эффектов:
- •Классификация сигнальных молекул:
- •Общие этапы действия сигнальных молекул:
- •72. Механизм действия липофильных сигнальных молекул. Механизм действия nо. Действие сигнальных молекул через тирозинкиназные рецепторы.
- •73. Гормоны и их отличительные признаки. Классификация гормонов. Роль гипоталамуса в гормональной регуляции.
- •Классификация гормонов и бав по химической структуре:
- •Функциональная классификация гормонов:
- •Общие свойства гормонов:
- •Гипоталамус
- •Либерины
- •Статины
- •74. Гормоны передней доли гипофиза, классификация, их химическая природа. Гормоны - простые белки, участие в регуляции метаболизма. Гормон роста.
- •75. Гормоны передней доли гипофиза – гликопротеины, их характеристика, участие в регуляции метаболизма (ттг,фсг,лг).
- •76. Семейство пептидов проопиомеланокортина. Гормоны задней доли гипофиза, место их образования, химическая природа, влияние на функции органов-мишеней.
- •Гормоны задней доли гипофиза:
- •77. Тиреоидные гормоны: синтез, строение, транспорт и механизм действия на метаболические процессы.
- •78. Тиреокальцитонин, паратиреоидный гормон. Химическая природа, участие в регуляции обмена веществ.
- •79. Инсулин, схема строения, участие в регуляции метаболических процессов. Специфика в действии на рецепторы органов мишеней.
- •80. Глюкагон: химическая природа и механизм действия. Влияние на обмен веществ. Соматостатин.
- •Соматостатин
- •81. Участие адреналина в регуляции обмена веществ. Структура, механизм гормонального действия, метаболические эффекты.
- •82. Кортикостероидные гормоны. Структура кортизола, механизм действия. Участие гормонов коры надпочечников в обмене веществ.
- •Кортикостероиды.
- •1. Глюкокортикоиды (кортикостерон, кортизол, кортизон).
- •2. Минералокортикоиды (альдостерон).
- •Механизм действия.
- •1. Глюкокортикоиды:
- •2. Минералокортикоиды:
- •83.Гормоны половых желез: эстрадиол, прогестерон и тестостерон, их строение, механизм действия и биологическая роль.
- •Эстрадиол
- •Механзм действия эстрогена:
- •Прогестерон
- •Механизм действия
- •Тестостерон
- •84. Межклеточный матрикс, его компоненты, функции. Характеристика коллагена, строение тропоколлагена. Полиморфизм коллагеновых белков.
- •Тропоколлаген:
- •Полиморфизм коллагеновых белков:
- •85. Этапы синтеза и созревания коллагена. Роль ферментов и витамина с в этом процессе. Катаболизм коллагена
- •Роль ферментов и витамина с.
- •Катаболизм коллагена
- •86. Особенности строения и функции эластина. Неколлагеновые структурные белки: фибронектин и ламинин.
- •Фибронектин
- •Ламинин
- •87.Протеогликаны межклеточного матрикса, их строение, функции. Образование надмолекулярных комплексов.
- •Малые протеогликаны
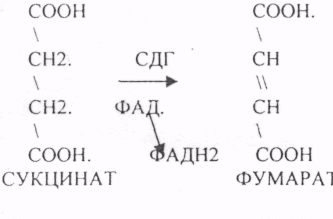
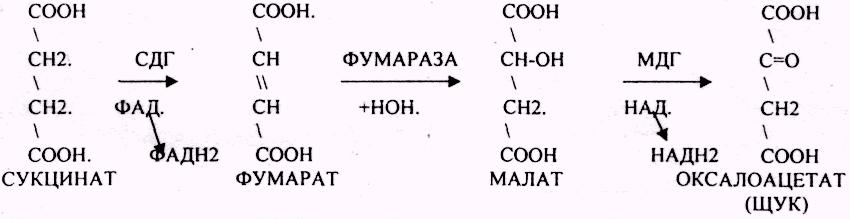
24. Цитратный цикл, химизм процесса, его биологическое значение.
ЦТК (цитратный цикл, цикл КРЕБСА).
В цикле КРЕБСА АЦЕТИЛ-КОА распадается до СО2 с образованием восстановленных КОФЕРМЕНТОВ - НАДН

АТФ в реакции не участвует, а используется энергия макроэргической связи АЦЕТИЛ-КОА ЦИТРИЛ-КОА не устойчив и очень быстро распадается под влиянием воды.
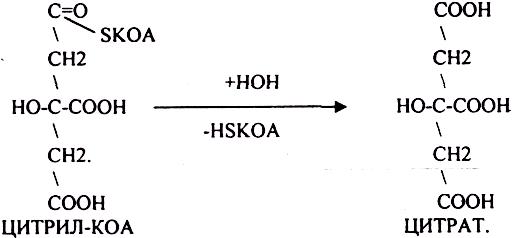
Лимонная кислота далее превращается в свой изомер (ИЗОЦИТРАТ) под влиянием фермента АКОНИТАЗЫ.
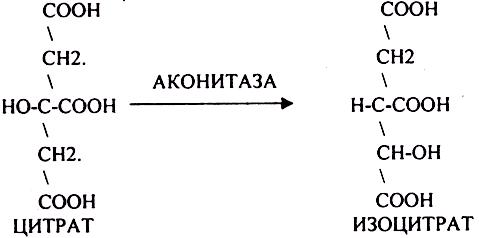
ИЗОЦИТРАТ подвергается далее ДЕГИДРИРОВАНИЮ под влиянием фермента -ИЗОЦИТРАТДЕГИДРОГЕНАЗЫ.
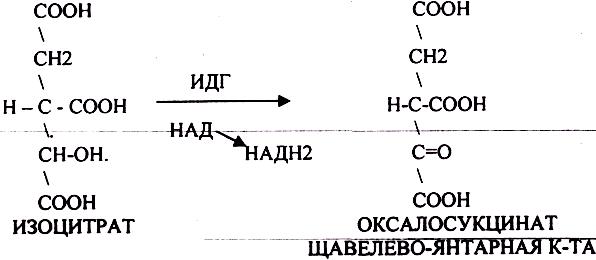
ЩЯВЕЛЕВО-ЯНТАРНАЯ К-ТА (а-кетоглутарат) подвергается ДЕКАРБОКСИЛИРОВАНИЮ достаточно легко и не требует участия дополнительных ферментов - ПРЯМОЕ ДЕКАРБОКСИЛИРОВАНИЕ.
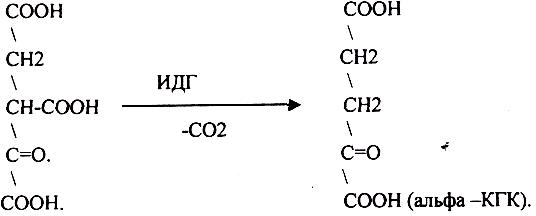
-КГК подвергается реакции ОКИСЛИТЕЛЬНОГО ДЕКАРБОКСИЛИРОВАНИЯ, катализируемой комплексом ферментов (КЕТОГЛУТАРАТДЕГИДРОГЕНАЗНЫЙ комплекс), включающий 3 фермента и 5 КОФЕРМЕНТОВ.
СУКЦИНИЛ-КОА подвергается реакции субстратного ФОСФОРИЛИРОВАНИЯ.
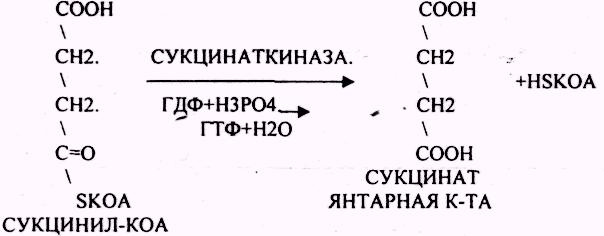
ГТФ + АДФ = ГДФ + АТФ
ФУНКЦИИ ЦТК.
1 .Катаболическая - распад АЦЕТИЛ КоА до Н2О и СО2
2.Анаболическая. Компоненты ЦТК могут использоваться для синтеза др. соединений
ЩУК - синтез АСП, МАЛAT - синтез глюкозы и т.д.
3.Интегративная. Взаимосвязь обмена БЖУ.
4.Энергетическая. Образование 1 молекулы АТФ. Если ЦТК работает вместе с дыхательной цепью, то образуется ещё 1 молекул АТФ.
5.ВОДОРОДГЕНЕРИРУЮЩАЯ - в результате ЦТК образуется 3 молекулы НАДН2 и 1 молекула ФАДН2, т.е. 4 пары молекул водорода. Они транспортируются в ЦТЭ.
25.Сопряжение реакций цикла цтк с дыхательной цепью ферментов.
Реакции ЦТК:
3лп6рпапоаапапа
Реакции ЦПЭ:
НАДН + Н + ФМН (FeS-белки) → ФМНН2
По укороченной цепи фад→ фадн2
26. Современные представления о биологическом окислении. Первичные акцепторы водорода. Электронно-транспортная цепь.
В биологических системах постоянно протекают процессы окисления органических веществ, в отличие от процессов горения они:
Протекают при низких температурах
В присутствии кислорода
Отсутствует пламя
Биологическое окисление – это многоступенчатый процесс транспорта электронов, осуществляемый комплексом ферментов (цпэ). То вещество, что отдаёт электроны, окисляется, то, что принимает, восстанавливается. Если акцептором электронов является кислород, то такой процесс называется ТКАНЕВЫМ ДЫХАНИЕМ. Биологическое окисление предполагает ДЕГИДРИРОВАНИЕ с образованием воды.
![]()
Если водород взаимодействует с кислородом с образованием воды вне организма, то это сопровождается взрывом. Многоступенчатая передача электронов и протонов сопровождается выделением энергии, часть которой запасается в виде АТФ, другая часть рассеивается в виде тепла.
Этот комплекс ферментов называется ЭЛЕКТРОН-ТРАНСПОРТНОЙ ЦЕПЬЮ (ЭТЦ), или ЦЕПЬЮ ПЕРЕНОСА ЭЛЕКТРОНОВ (ЦПЭ), или дыхательной цепью. ЭТЦ - это своеобразный конвеер по переносу электронов и протонов от субстрата к кислороду.
Первичные акцепторы протонов и электроногв.
ФАД- и НАД-зависимые дегидрогеназы.
1. В НАД-зависимый ДГ НАД – кофермент, рабочая часть – никотинамид.

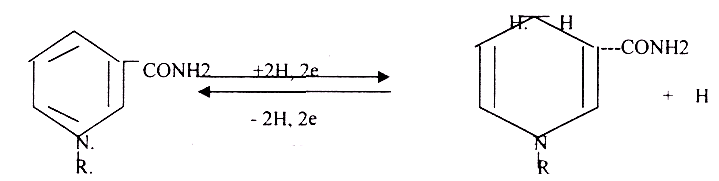
Никотинамид
2.В ФАД-зависимых ДГ в качастве кофермента – ФАД, рабочая часть – изоаллоксазин.
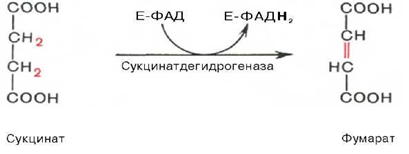
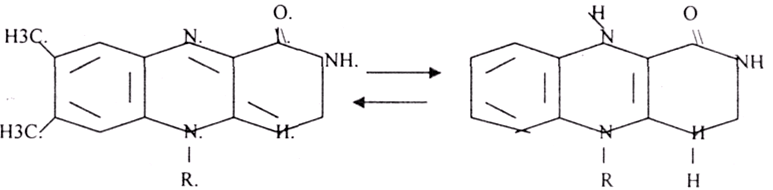
Восстановленные НАДН иФАДН отдают протоны и электроны в ЦТК