
- •1.Биохимия, её задачи. Значение биохимия для медицины.
- •Задачи биохимии:
- •Значение биохимии для медицины.
- •2.Аминокислоты, их классификация. Строение и биологическая роль аминокислот.
- •Строение:
- •Функции аминокислот:
- •3.Строение белков. Уровни структурной организации белка. Характеристика связей, стабилизирующих их. Доменные белки.
- •Структурная организация белков.
- •4.Электро-химические свойства белков как основа методов их исследования. Электрофорез белков крови.
- •5.Коллоидные свойства белков. Гидратация. Растворимость. Денатурация, роль шаперонов.
- •Гидратация
- •Растворимость
- •6. Принципы классификации белков. Простые и сложные белки. Характеристика простых белков: гистоны, протамины, альбумины, глобулины.
- •Простые белки.
- •7.Современные представления о структуре и функциях нуклеиновых кислот. Первичная и вторичная структуры днк. Строение мономеров нуклеиновых кислот. Нуклеопротеины. Методы исследования днк (пцр).
- •Первичная структура днк.
- •Вторичная структура днк.
- •Нуклеопротеины
- •Полимеразная цепная реакция.
- •8. Хромопротеины. Строение и функции гемоглобина. Типы гемоглобина. Миоглобин.
- •Гемоглобин.
- •9. Липид-белковые комплексы. Строение липидных компонентов. Структурные протеолипиды и липопротеины, их функции.
- •Свободные липопротеины
- •Структурные протеолипиды
- •10. Ферменты, их химическая природа, структурная организация. Активный центр ферментов, его свойства.
- •Строение ферментов.
- •11. Коферменты и их функции в ферментативных реакциях. Витаминные коферменты. Примеры реакций с участием витаминных коферментов. Тиаминовые коферменты, тдф.
- •Тиаминовые коферменты, тдф.
- •12. Никотинамидные коферменты. Структура над, надф. Примеры реакций.
- •13. Флавиновые коферменты. Структура фмн,фад. Примеры реакций.
- •14. Пиридоксиновые коферменты. Строение пф, примеры реакций.
- •15. Роль фолиевой кислоты и в12 в реакциях трансметилирования, s-аденозилметионин, его образование. Пример реакции с цчастием фолиевой кислоты и в12.
- •16. Свойства ферментов. Лабильность конформации, влияние температуры и pH среды. Специфичность действия ферментов, примеры реакций.
- •17. Номенклатура и классификация ферментов. Характеристика класса оксидоредуктаз, примеры реакций.
- •6 Классов:
- •18. Характеристика класса трансфераз и гидролаз. Примеры реакций.
- •19.Лиазы, изомеразы, лигазы. Характеристика, примеры реакций с участием ферментов этих классов.
- •20. Современные представления о механизме действия ферментов. Стадии ферментативного катализа, молекулярные эффекты, примеры.
- •21. Ингибирование ферментов. Конкурентное и неконкурентное ингибирование, примеры реакций. Лекарственные вещества, как ингибиторы ферментов.
- •22. Понятие об изоферментах. Характеристика изоферментов Лактатдегидрогеназы (лдг) и креатинкиназы (кк). Использование ферментов в медицине. Энзимодиагностика, энзимотерапия. Энзимопатология, примеры.
- •23. Обмен веществ и энергии. Этапы обмена веществ. Общий путь катаболизма. Окислительное декарбоксилирование пирувата.
- •Окислительное декарбоксилирование пвк
- •24. Цитратный цикл, химизм процесса, его биологическое значение.
- •25.Сопряжение реакций цикла цтк с дыхательной цепью ферментов.
- •По укороченной цепи фад→ фадн2
- •26. Современные представления о биологическом окислении. Первичные акцепторы водорода. Электронно-транспортная цепь.
- •Первичные акцепторы протонов и электроногв.
- •Электронно-транспортная цепь
- •27.Характеристика компонентов электрон-транспортной цепи
- •28. Пути синтеза атф. Субстратное фосфорилирование (пример). Молекулярные механизмы окислительного фосфорилирования (теория Митчелла). Разобщение окисления и фосфорилирования.
- •Механизм окислительного фосфорилирования
- •29. Альтернативные пути биологического окисления, оксигеназный путь. Микросомальные монооксигеназы.
- •30. Свободнорадикальное окисления. Токсичность кислорода. Активный формы кислорода. Антиокислительная защита. Роль сро в патологии.
- •31. Белки: роль, потребность, биологическая ценность. Строение незаменимых ак. Превращение белков в желудке, роль соляной кислоты. Действие пептид гидролаз. Анализ желудочного содержимого.
- •Переваривание белков
- •32.Превращение белков в желудке. Роль соляной кислоты в переваривании белков. Показать действие пепсина на конкретном примере.
- •33. Переваривание белков в кишечнике.
- •34. Гниение белков и аминокислот в кишечнике. Пути образования продуктов гниения. Примеры.
- •1.Декабоксилирование
- •35. Механизм обезвреживания продуктов гниения белков. Роль фафс и удф-гк.
- •36. Трансаминирование и декарбоксилирование аминокислот.
- •37. Декарбоксилирование аминокислот, образование биогенных аминов. Роль в этом процессе пф.
- •38. Реакции дезаминирования аминокислот.
- •1. Неокислительное
- •2. Внутримолекулярное:
- •39.Оринтиновый цикл.
- •40. Особенности катаболизма пуриновых нуклеотидов. Их строение и распад. Образование мочевой кислоты. Подагра.
- •41. Генетический код и его свойства.
- •Свойства:
- •42. Механизмы репликации днк. Условия необходимые для репликации. Основные этапы репликации.
- •Основы для репликации:
- •Условия репликации:
- •Этапы репликации:
- •43. Биосинтез рнк (транскрипция). Условия и этапы транскрипции.
- •Условия транскрипции:
- •Этапы Транскрипции:
- •44. Процессинг рнк. Альтернативный сплайсинг.
- •45.Биосинтез белка. Белково-синтетический ферментативный комплекс.
- •Белковые факторы:
- •46. Этапы трансляции и их характеристика.
- •47. Посттрансляционный процессинг. Виды химической модификации, фолдинг, роль шаперонов.
- •48. Строение оперона. Регуляция биосинтеза белка у прокариотов. Функционирование лактозного и гистидинового оперонов.
- •Регуляция оперона по методу индукции.
- •Регуляция оперона по методу репрессии
- •49. Особенности и уровни регуляции биосинтеза белка у эукариотов. Амплификация генов, энхансерные и сайленсерные элементы.
- •1. На уровне генов:
- •6. Регуляция на уровне трансляции:
- •50. Современные представления о структурно-функциональной организации днк. Основные направления молекулярной биологии: геномика, транскриптомика, рн-омика, протеомика.
- •51. Ингибиторы белковых синтезов. Действие антибиотиков и токсинов. Биологическая роль теломер и теломераз.
- •Токсины
- •Теломеры и теломеразы. Их роль в развитии опухолевого роста.
- •52. Виды молекулярных мутаций и их биологические последствия.
- •1. Замена:
- •2. Вставка:
- •53. Биохимический полиморфизм и его биологическая роль. Непереносимость пищевых веществ и лекарств.
- •54. Основные углеводы, их строение и классификация, биологическая роль.
- •Гомополисахариды
- •Гетерополисахариды
- •55. Роль углеводов в питании. Переваривание и всасывание углеводов в органах пищеварительной системы. Написать реакции.
- •56. Катаболизм глюкозы в анаэробных условиях. Химизм процесса, биологическая роль.
- •57. Катаболизм глюкозы в тканях в аэробных условиях. Гексозодифосфатный путь превращения глюкозы и его биологическая роль. Эффект Пастера.
- •1. Этапы аэробного гликолиза
- •Эффект Пастера
- •58. Гексозомонофосфатный путь превращения глюкозы в тканях и его биологическая роль. Химизм реакций окислительной стадии.
- •1. Транскетолазные реакции:
- •2. Трансальдолазная реакция:
- •59. Биосинтез и распад гликогена в тканях. Биологическая роль этих процессов
- •Распад гликогена
- •1. Основной фосфоролитический путь
- •2.Неосновной амилолитический.
- •60. Глюконеогенез. Возможные предшественники, последовательность реакций, биологическая роль.
- •61.Характеристика основных липидов организма человека, их строение, классификация, суточная потребность и биологическая роль.
- •62. Эйкозаноиды - регуляторы обмена веществ; химическая природа, биологические эффекты эйкозаноидов.
- •1.Простагландины:
- •63.Биологическая роль липидов пищи. Переваривание, всасывание липидов в органах пищеварительной системы. Жёлчные кислоты. Их строение, биологическая роль
- •64. Характеристика липопротеинов крови, их биологическая роль.
- •65.Окисление высших жирных кислот в тканях. Химизм реакций, биологическая роль
- •66.Окисление глицерола. Химизм реакций, биологическая роль.
- •67. Биосинтез высших жирных кислот в тканях. Химизм реакций, биологическая роль.
- •68.Холестерол. Его химическое строение, биосинтез и биологическая роль.
- •69. Образование кетоновых тел в тканях. Биологическое значение кетоновых тел. Кетоацидоз.
- •70. Сигнальные молекулы, их классификация. Виды регуляторных эффектов сигнальных молекул. Понятие о клетке мишени.
- •Задачи:
- •Особенности сигнальных молекул:
- •Виды регуляторных эффектов:
- •Классификация сигнальных молекул:
- •Общие этапы действия сигнальных молекул:
- •72. Механизм действия липофильных сигнальных молекул. Механизм действия nо. Действие сигнальных молекул через тирозинкиназные рецепторы.
- •73. Гормоны и их отличительные признаки. Классификация гормонов. Роль гипоталамуса в гормональной регуляции.
- •Классификация гормонов и бав по химической структуре:
- •Функциональная классификация гормонов:
- •Общие свойства гормонов:
- •Гипоталамус
- •Либерины
- •Статины
- •74. Гормоны передней доли гипофиза, классификация, их химическая природа. Гормоны - простые белки, участие в регуляции метаболизма. Гормон роста.
- •75. Гормоны передней доли гипофиза – гликопротеины, их характеристика, участие в регуляции метаболизма (ттг,фсг,лг).
- •76. Семейство пептидов проопиомеланокортина. Гормоны задней доли гипофиза, место их образования, химическая природа, влияние на функции органов-мишеней.
- •Гормоны задней доли гипофиза:
- •77. Тиреоидные гормоны: синтез, строение, транспорт и механизм действия на метаболические процессы.
- •78. Тиреокальцитонин, паратиреоидный гормон. Химическая природа, участие в регуляции обмена веществ.
- •79. Инсулин, схема строения, участие в регуляции метаболических процессов. Специфика в действии на рецепторы органов мишеней.
- •80. Глюкагон: химическая природа и механизм действия. Влияние на обмен веществ. Соматостатин.
- •Соматостатин
- •81. Участие адреналина в регуляции обмена веществ. Структура, механизм гормонального действия, метаболические эффекты.
- •82. Кортикостероидные гормоны. Структура кортизола, механизм действия. Участие гормонов коры надпочечников в обмене веществ.
- •Кортикостероиды.
- •1. Глюкокортикоиды (кортикостерон, кортизол, кортизон).
- •2. Минералокортикоиды (альдостерон).
- •Механизм действия.
- •1. Глюкокортикоиды:
- •2. Минералокортикоиды:
- •83.Гормоны половых желез: эстрадиол, прогестерон и тестостерон, их строение, механизм действия и биологическая роль.
- •Эстрадиол
- •Механзм действия эстрогена:
- •Прогестерон
- •Механизм действия
- •Тестостерон
- •84. Межклеточный матрикс, его компоненты, функции. Характеристика коллагена, строение тропоколлагена. Полиморфизм коллагеновых белков.
- •Тропоколлаген:
- •Полиморфизм коллагеновых белков:
- •85. Этапы синтеза и созревания коллагена. Роль ферментов и витамина с в этом процессе. Катаболизм коллагена
- •Роль ферментов и витамина с.
- •Катаболизм коллагена
- •86. Особенности строения и функции эластина. Неколлагеновые структурные белки: фибронектин и ламинин.
- •Фибронектин
- •Ламинин
- •87.Протеогликаны межклеточного матрикса, их строение, функции. Образование надмолекулярных комплексов.
- •Малые протеогликаны
19.Лиазы, изомеразы, лигазы. Характеристика, примеры реакций с участием ферментов этих классов.
Лиазы – ферменты, которые отщепляют определенные группы от субстрата негидролитическим путем или присоединяют воду по месту разрыва двойной связи.
Фумараза
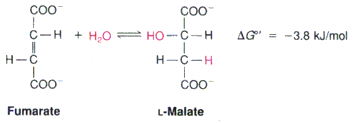
Изомеразы – ферменты, катализирующие различные внутримолекулярные превращения, когда вещество переходит в свой изомер.
Глю-6-фосфатизомераза
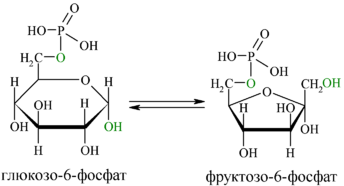
Если изомеризация заключается во внутримолекулярном переносе атома из одного положения в другое, то фемент называют мутазой, например, получение глюкозо-1-фосфата из глю-6-фосфата.
Лигазы (синтетазы) – катализируют реакции приссоединения друг к другу нескольких молекул с образованием более сложного вещества. Для этих реакций необходима энергия, если донор – АТФ, то фермент – синтетаза. Если донор другое макроэргическое соединение, то фермент – синтаза.
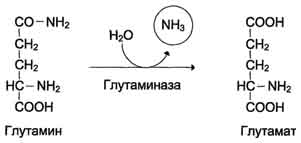
20. Современные представления о механизме действия ферментов. Стадии ферментативного катализа, молекулярные эффекты, примеры.
С термодинамической точки зрения, действие любого фермента направлено на понижение энергии активации. Энергия активации - это то дополнительное количество энергии, которое нужно сообщить молекуле, чтобы перевести её из неактивного состояния в состояние активности. Чем ниже энергия активации, тем выше скорость реакции. 70 лет назад была предложена теория Михаэлиса и Ментенома. Они выдвинули понятие о F-S комплексе. Фермент взаимодействует с субстратом, образуя нестойкий промежуточный F-S комплекс, который затем распадается с образованием продуктов реакции (Р) и освобождением фермента. В этом процессе выделяют несколько стадий:
1.Диффузия субстрата к ферменту и их стерическое взаимодействие с образованием F-S комплекса.
E


 +S=ES.
Эффект
концентрации
молекул
субстрата в области активного центра
фермента. Уменьшается расстояние между
субстратом и активным центром, что
увеличивает скорость взаимодействия.
+S=ES.
Эффект
концентрации
молекул
субстрата в области активного центра
фермента. Уменьшается расстояние между
субстратом и активным центром, что
увеличивает скорость взаимодействия.
Э
 ффект
ориентации – в
процессе сближения фермент и субстрат
ориентируются друг к другу теми
функциональными группами, которые
принимают участиев катализе. Это возможно
благодаря вращательным движениям
фермента субстрата.
ффект
ориентации – в
процессе сближения фермент и субстрат
ориентируются друг к другу теми
функциональными группами, которые
принимают участиев катализе. Это возможно
благодаря вращательным движениям
фермента субстрата.


Э ффект
индуцированного соответствия –
характерен для ферментов обладающих
свойством групповой специфичности.
Субстрат, взаимодействуя с активным
центром фермента вызывает изменение
его конформации на благоприятную для
химического превращения субстрата.
ффект
индуцированного соответствия –
характерен для ферментов обладающих
свойством групповой специфичности.
Субстрат, взаимодействуя с активным
центром фермента вызывает изменение
его конформации на благоприятную для
химического превращения субстрата.
Эта стадия не продолжительна. Её скорость зависит от концентрации субстрата и скорости диффузии его к активному центру фермента. На этой стадии практически не происходит понижения энергии активации.
2.Преобразование F-S комплекса в один, или несколько, активированных комплексов, при этом происходит расслабление и разрыв старых химических связей в молекуле субстрата под действием каталитических групп активного центра фермента.
E+S=ES*=ES**
Эффект натяжения ("дыбы"). До присоединения субстрата к активному центру фермента, его молекула как бы в расслабленном состоянии. После связывания молекула субстрата растягивается и принимает напряжённую деформированную конфигурацию. При этом увеличивается длина межатомных связей, следовательно, понижается Е активации.
Кислотно-основный катализ: аминокислотные остатки в составе активного цента имеют функциональные группы кислотного и основного характера. Кислотные группы в реакциях доноры, а основные – акцепторы. В результате заряженные частицы перераспределяются, разрушаются старые и образуются новые связи.
Ковалентный катализ: между субстратом и активным центром фермента формируются ковалентные связи , по окончанию катализы эти связи разрушаются и продукт высвобождается, поэтому у продукта появляются новые связи.
Эта стадия является наиболее продолжительной по времени. При этом происходит разрыв связей в молекуле субстрата, образование новых связей, т.е. образуются Р реакции. Е активации снижается.
3.Образование и освобождение продуктов реакции от фермента и поступление их в окружающую среду. ES**=EP=E+P. Образующиеся продукты диффундируют в окружающую среду, а активный центр освобождается. Стадия непродолжительна, снижение энергии активации незначительно.
