
- •Г.А. Тихановская, л.М. Воропай, в.В. Кочетова химия
- •Предисловие
- •Введение
- •Основные химические понятия и законы
- •2. Характеристика жидких химических систем. Свойства растворов
- •2.1. Способы выражения концентрации растворов
- •2.2. Физико-химические свойства растворов неэлектроитов
- •2.2.1. Осмотическое давление разбавленных растворов
- •2.2.2. Давление пара разбавленных растворов неэлектроитов. Первый закон Рауля.
- •2.2.3. Понижение температуры замерзания и повышение температуры кипения растворов. Второй закон Рауля.
- •2.3. Физико-химические свойства растворов электролитов
- •2.4. Ионное произведение воды. Водородный показатель
- •2.5. Гидролиз солей
- •2.6. Произведение растворимости
- •3. Термохимия. Закон гесса
- •4. Второе начало термодинамики. Изменение энтропии в различных процессах
- •5.Энергия гиббса и направленность химических процессов
- •6. Скорость химической реакции
- •7. Зависимость скорости химической реакции от температуры
- •8. Химическое равновесие
- •9. Окислительно-восстановительные реакции
- •9.1. Электродные потенциалы и электродвижущие силы
- •Стандартные электронные потенциалы(∆е0) некоторых металлов
- •9.2. Электролиз
- •9.3. Коррозия металлов
- •10. Основы химии вяжущих веществ
- •10.1. Неорганические вяжущие вещества
- •10.2. Известь
- •10.3. Портландский цемент
- •10.4. Коррозия бетона и методы борьбы с ней
- •Контрольные задачи
- •1. Основные химические понятия и законы
- •2. Способы выражения концентрации растворов
- •Физико-химические свойства растворов неэлектролитов
- •3.1. Осмотическое давление растворов неэлектролитов
- •3.2 Давление пара разбавленных растворов неэлектролитов. Первый закон Рауля
- •3.3. Понижение температуры замерзания и повышение температуры кипения растворов. Второй закон Рауля
- •4. Свойства растворов электролитов
- •5. Ионное произведение воды. Водородный показатель
- •6. Гидролиз солей
- •7. Произведение растворимости
- •8. Термохимия. Закон гесса
- •9. Второе начало термодинамики. Изменение энтропии в различных процессах
- •10. Энергия гиббса и направленность химических процессов
- •11. Скорость химической реакции
- •12. Зависимость скорости химической реакции от температуры
- •13. Химическое равновесие
- •14. Электрохимия
- •15. Химия вяжущих веществ
- •Глоссарий
- •Произведение растворимости малорастворимых веществ в воде при 25оС
- •Термодинамические константы некоторых веществ
- •Библиографический список
- •Оглавление
2. Способы выражения концентрации растворов
Кристаллическая сода

 какой массы потребуется для приготовления
раствора объемом 12
л, если его:
какой массы потребуется для приготовления
раствора объемом 12
л, если его:
а) молярная концентрация равна 0.2 моль/л;
б) эквивалентная концентрация равна 0.2 моль/л?
Медный купорос
 какой массы потребуется для приготовления
раствора объемом 2 л, содержащего
количеством вещества 0.5 моль? Какова
молярная концентрация полученного
раствора?
какой массы потребуется для приготовления
раствора объемом 2 л, содержащего
количеством вещества 0.5 моль? Какова
молярная концентрация полученного
раствора?Чему равны массы хлорида бария безводного и кристаллогидрата
 ,
которые надо взять для приготовления
раствора(
,
которые надо взять для приготовления
раствора( 1.072г
1.072г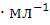 )
объемом 1.5 л, в котором
(
)
объемом 1.5 л, в котором
( )
= 0.08? Какой объем воды потребуется в том
и другом случае?
)
= 0.08? Какой объем воды потребуется в том
и другом случае?Какие массы безводного сульфата меди и медного купороса потребуются для приготовления раствора (
 1.084
г
1.084
г  )
объемом 1 л, для которого
)
объемом 1 л, для которого  (
)
= 0.08 ?
(
)
= 0.08 ?
5.
Определите эквивалентную концентрацию
8-процентного раствора гидроксида натрия
(
1.092
г ![]() ).
).
6. Определите нормальную концентрацию 10-процентного раствора серной кислоты ( 1.07 г ).
7. Сколько миллилитров 96-процентного (по массе) раствора
( 1.84 г ) нужно взять для приготовления 1 л 0.25Н раствора?
Плотность 40-процентного (по массе) раствора
 равна
1.25 г
равна
1.25 г
Рассчитать молярность, моляльность этого раствора.
Вычислите массовую долю
 в растворе и моляльность 8Н раствора
,
плотность которого равна 1246 г
.
в растворе и моляльность 8Н раствора
,
плотность которого равна 1246 г
.Какой объем раствора гидроксида калия с массовой долей КОН 24% ( 1218 г ) можно приготовить из 125 л раствора гидроксида калия с массовой долей КОН 0.48 ( 1510 г )?
11.
Определите эквивалентную концентрацию,
моляльность и массовую долю ![]() в
растворе, если плотность раствора равна
1000 г
.
в
растворе, если плотность раствора равна
1000 г
.
Какой объем 5Н раствора NaOH можно приготовить из 4 л раствора гидроксида натрия с массовой долей NaOH 0.50 ( 1510 г )?
Плотность 15-процентного (по массе) раствора
 равна 1105 г
равна 1105 г .
Вычислите нормальность, молярность,
моляльностъ раствора.
.
Вычислите нормальность, молярность,
моляльностъ раствора.Из 3 л раствора с массовой долей КОН 0.50 и плотностью 1.09 г
 нужно приготовить раствор с массовой
долей КОН 0.10 (
1.09
г
).
Сколько воды нужно взять для приготовления
указанного раствора?
нужно приготовить раствор с массовой
долей КОН 0.10 (
1.09
г
).
Сколько воды нужно взять для приготовления
указанного раствора?Из 5 л раствора гидроксида калия с массовой долей КОН 0.50 и плотностью 1538 г надо приготовить раствор с массовой долей КОН 0.18. Какой объем воды надо взять?
Какой объем раствора серной кислоты с массовой долей 0.96 ( 1835 г ) нужно взять для приготовления 5 л 0.5Н раствора ?
Какой объем 50-процентного раствора КОН ( 1.538 г ) требуется для приготовления 3 л 6-процентного раствора 1.048 г )?
Какой объем 0.1Н можно приготовить из 0.7 л раствора азотной кислоты с массовой долей 30% ( 1180 г )?
К 100 мл 96-процентной (по массе) ( I.84 г ) прибавили 400 мл воды. Получился раствор плотностью 1.220 г . Вычислить его эквивалентную концентрацию и массовую долю .
Сколько миллилитров концентрированной соляной кислоты ( 1.19 г ), содержащей 38% (масс.) НСl, нужно взять для приготовления в 2 Н раствора?
Смешаны 0.8 л 1.5 Н NаOH и 0.4 л 0.6 Н NaOH. Какова эквивалентная концентрация полученною раствора?
Водный раствор содержит 577 г в 1 л. Плотность раствора 1335 г . Вычислите массовую долю в растворе, а также эквивалентную концентрацию раствора.
Определите молярную концентрацию и молярную концентрацию эквивалента в растворе, в котором массовая дола 0.98, а 1.84 г .
К 0.78 л раствора NaOH с массовой долей 0.20 и 1.225 г прибавили 0.14 л раствора с массовой долей NаОН 0.10 и 1.115 г . Определите массовую долю NaOH в полученном растворе.
Какой объем раствора серной кислоты с массовой долей 0.3 ( 1219 г ) можно приготовить из 12 кг раствора серной кислоты с массовой долей 0.6.
