
- •Министерство образования Республики Беларусь Международный государственный экологический университет имени а.Д.Сахарова
- •Оглавление обозначения и сокращения
- •Введение
- •Глава 1. Гемоглобин и его соединения
- •Строение гемоглобина
- •Транспортно-дыхательная функция
- •Градация гемоглобинов
- •Типы гемоглобинов
- •1.4.1 Нормальные формы гемоглобина
- •1.4.2. Патологические формы гемоглобина
- •Глава 2. Метгемоглобин - биологический маркер загрязнения окружающей среды
- •2.1. Образование метгемоглобина
- •2.2.Метгемоглобинообразователи
- •Глава 3. Метгемоглобинемии
- •3.1. Первичные (наследственные) метгемоглобинемии
- •3.2. Вторичные (токсические) метгемоглобинемии
- •3.3.Клинические проявления метгемоглобинемии
- •Глава 4. Механизмы регуляции уровня метгемоглобина
- •Глава 5. Материалы и методы исследования
- •5.1. Определение в крови содержания метгемоглобина по л.Э. Горну
- •5.1.1. Проведение анализа
- •5.1.2. Методические замечания
- •Глава 6. Результаты и их обсуждение
- •Заключение
Оглавление обозначения и сокращения
Hb -гемоглобин
PHK – рибонуклеиновая кислота
HbCO - карбоксигемоглобин
MetHb – метгемоглобин
НАДФ+ - никотанамидадениндинуклеотидфосфат, окисленная форма
НАДФН – никотинамидадениндинуклеотидфосфат, восстановленная форма
АФК – актавные формы кислорода
НЭМ – наследственная энзимопатическая метгемоглобинемия
Введение
Изучение механизмов, лежащих в основе биохимических процессов нарушения кислородтранспортной функции крови, является актуальной задачей современной биологии и медицины.
Одно из основных звеньев в цепи метаболических нарушений системы транспорта кислорода кровью – реакции трансформации гемоглобина в его неактивную форму – метгемоглобин. В связи с этим существует необходимость поиска методов и средств коррекции такого рода повреждений, повышающих эффективность окислительно-восстановительных процессов восстановления метгемоглобина.
Особенно важное значение данная проблема приобрела в Республике Беларусь, где на значительной территории отмечается наличие высокого уровня как радионуклидов так и нитросоединений, способствующих как наследственному нарушению естественных метгемоглобинредуктазных систем, так и приводящих к избыточному метгемоглобинообразованию.
Поэтому важны и актуальны как работы в области синтеза новых соединений с высокой биологической активностью обладающих низкой токсичностью и подобных по структуре природным биосубстратам и коферментам, так и исследования взаимосвязи структуры соединений с их способностью активировать процессы восстановления метгемоглобина.
Глава 1. Гемоглобин и его соединения
Гемоглобин (Hb) (от греч. haemo - кровь и лат. globus - шар), красный железосодержащий пигмент крови человека, позвоночных и некоторых беспозвоночных животных. Относится к сложным белкам - хромопротеидам. В организме Hb выполняет транспортно-дыхательную и буферную функции [1].
Молекулярная масса основных типов гемоглобина колеблется в пределах 64 500-68 000 Д. Молярная масса гемоглобина, растворённого в плазме, - до 3 000 000 Д. Молекулярная масса различных протомеров колеблется от 16 000 до 17 000 Д. Размер Hb - 6,8 нм; размер миоглобина -3,6 нм [1, 4].
Белковая часть Hb характеризуется очень высоким содержанием остатков гистидина. Это придает ему значительную буферную емкость при рН около 7, что весьма важно для той роли, которую играют эритроциты в переносе кровью дыхательных газов. Изоэлектрическая точка – 7 [2].
Синтез белковой части Hb происходит на самой ранней стадии эритропоэза (базофильные эритробласты богаты РНК). Синтез гема и соединение его с глобином, т. е. образование гемоглобина, осуществляется на более поздних этапах эритропоэза, в период превращения базо-фильного нормобласта в полихроматофильный нормобласт. По мере созревания нормобластов количество гемоглобина в них увеличивается и достигает максимума в эритроцитах [2].
Строение гемоглобина
Пространственная структура молекулы гемоглобина в деталях изучена методом рентгеноструктурного анализа еще в конце 40-х гг. XX в., главным образом благодаря работам английского биофизика М. Перутца [2]. За эти исследования он был удостоен Нобелевской премии.
Гемоглобин является сложным белком, представленным двумя частями: небелковая планарная часть - гем (4 % молекулы гемоглобина) и белковая олигомерная глобула (96 %) [3].
Гем (протогем) - тетрапиррольная ароматическая структура протопорфирина IX, в состав которого обязательно входит ион Fe2+. SР2-гибридные атомы С и N π-электронной системы порфиринового лиганда обеспечивают его плоскостную структуру [4, 9].
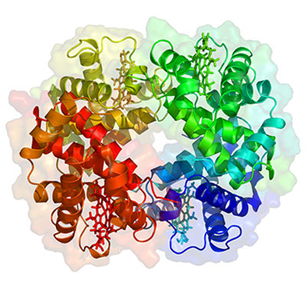
Рис 1. Структура гемоглобина
Гем является простетической группой гемсодержащих белков, обеспечивающей их главные функции: связывание и транспорт кислорода, участие в цепи переноса электронов, восстановление кислорода до воды, микросомальное окисление, разложение перекисей и др. Присутствие иона Fе2+ и ароматическая природа тетрапиррольного ядра обеспечивают интенсивную окраску гема, что и позволяет относить гемсодержащие белки к классу хромопротеидов [3, 10].
В состав порфиринового ядра гема входит ион Fе2+. Именно ион Fе2+, но не Fе3+, может связываться с кислородом. Свободные ионы Fе2+ спонтанно окисляются до Fе3+, поэтому неорганическое железо не может быть хорошим переносчиком кислорода. Fе2+ в составе гема (без глобина) может связывать кислород, но и оно быстро окисляется, образуя гематин. Поэтому (а также в силу плохой растворимости в воде) свободный гем тоже не способен к транспорту кислорода [11].
Глобин — белковый компонент гемоглобина - принадлежит к группе гистонов. Число аминокислотных остатков в полипептидной цепи разных типов колеблется в диапазоне от 140 до 150, причем чаще встречаются числа 141, 146, 153. В состав протомеров гемоглобина человека входит либо 141 (α-цепь), либо 146 (β-, γ-, δ-цепи) аминокислотных остатков [3, 4, 9, 12].
Вторичная структура гемоглобинов представлена α-спиралью. Полипептидные цепи в ге-моглобиновой молекуле более чем на 70 % представлены скрученными в α-геликсовые спирали, фрагменты которых разделены участками, образующими изгибы вторичной цепи. В результате такой укладки образуются третичные глобулы овоидной формы [13].
Число спирализованных участков различно у разных цепей Нb. α-Цепь имеет 7 таких доменов, β-цепь - 8. Спирализованные фрагменты гемоглобина обозначают латинскими буквами, начиная с О конца полипептидной цепи (например, в α-субъединице: А, В, С, D, Е, F, Н).
Пространственная компоновка третичной структуры субъединиц гемоглобина соответствует принципам третичной укладки большинства глобулярных белков: максимальная компактность, гидрофобные аминокислотные радикалы расположены внутри глобулы, большинство гидрофильных аминокислотных остатков располагаются на поверхности протомера [3].
Физиологической формой четвертичной структуры гемоглобинов человека является тетрамерная. Все четыре протомера гемоглобина располагаются пространственно в определенном соотношении («кватернерная структура»), образуя по отношению друг к другу тетраэдрическую конфигурацию. Тетрамер гемоглобина - сфероид длиной 64А, шириной 55А и высотой 50А [6]. Каждая сведбергова единица находится в контакте с тремя другими сведберговыми единицами, рыхло связанными между собой нековалентными связями (водородными, солевыми и, в основном, гидрофобными). Неполярные гидрофобные связи, будучи обращенными внутрь белка, играют главную роль в стабилизации четвертичной структуры гемоглобина [13, 14].
