
- •1.3.1 Вимірювання роботи виходу, базовані на визначенні крп. 18
- •1.3.2 Інші методи вимірювання роботи виходу. 21
- •Оглядова частина.
- •1. Емісійні властивості поверхні.
- •1.1 Робота виходу.
- •1.2 Контактна різниця потенціалів.
- •1.3 Методи вимірювання роботи виходу.
- •1.3.1 Вимірювання роботи виходу, базовані на визначенні крп.
- •1.3.2 Інші методи вимірювання роботи виходу.
- •2. Адсорбція.
- •2.1 Адсорбція. Види адсорбції.
- •2.2 Порівняння фізичної адсорбції і хемосорбції.
- •2.3 Активована адсорбція.
- •2.4 Взаємодія між частинками, адсорбованими на поверхні металлу.
- •2.5 Хімічна адсорбція як хімічний зв’язок.
- •2.6 Хімічна адсорбція як двохелектронний зв’язок.
- •2.7 Адсорбційні центри.
- •2.8 Властивості адсорбційних центрів.
- •2.9 Характеристики адсорбції.
- •2.9.1 Час адсорбції.
- •2.9.2 Кінетика адсорбції.
- •3. Огляд експериментальних робіт.
- •3.1 Фізичні властивості тонких мідних плівок.
- •3.2 Взаємодія поверхонь інших металів з киснем.
- •Експериментальна частина.
- •4.Основні завдання.
- •4.1 Препарування зразків. Вакуумні умови.
- •4.2. Визначення товщини плівок та маси осадженого кисню.
- •4.6.Зміна маси міді за рахунок зростання окисного шару.
- •Висновки. Список використаних джерел
- •1. Вступ
- •1.2 Аналіз стану виробничих умов.
- •1.3 Організаційно - технічні заходи
2.3 Активована адсорбція.
Активованою адсорбцією називають усяку адсорбцію, що вимагає активації. Адсорбцію, яка протікає без активації, називають нормальною.
Слід розрізняти активовану адсорбцію й хімічну адсорбцію. Не всяка хімічна адсорбція є активованою адсорбцією, тобто вимагає енергії активації. Хімічна адсорбція в деяких випадках може протікати й без енергії активації. З іншої сторони не завжди активована адсорбція свідчить про хімічну природу адсорбційних сил. Наявність активаційного бар'єру не є необхідною ознакою хімічної адсорбції. Такий бар'єр може мати місце в деяких випадках і при фізичній адсорбції.
Інакше кажучи, відсутність або наявність енергії активації при адсорбції ще нічого не говорить про природу адсорбційних сил. Активовану адсорбцію можна відрізнити від нормальної характером її кінетики [7]. При нормальній адсорбції швидкість адсорбції падає (причому порівняно повільно) при підвищенні температури. Чим вища температура, тим повільніше протікає адсорбція,
У випадку активованої адсорбції швидкість адсорбції, навпаки, різко зростає з ростом температури. Нагрівання прискорює процес адсорбції.
2.4 Взаємодія між частинками, адсорбованими на поверхні металлу.
Головну роль у взаємодії між хемосорбованими адчастинками відіграють [8]:
1) електростатична взаємодія, основною складовою якої є кулонівське або диполь-дипольне відштовхування адчастинок;
2) пряма взаємодія, істотна тільки для близьких до моношарових покриттів;
3) непряма взаємодія, що має далекодіючий осцилюючий характер, обумов-лений електронною структурою підкладки.
Для лужних адатомів, що характеризуються великою полярністю зв'язку, основну роль відіграє електростатична взаємодія. Роль непрямої взаємодії збільшується при переході від лужних до лужноземельних, рідкоземельних і перехідних адатомів, а при адсорбції атомів простих газів вона відіграє основну роль. Зростає також роль непрямої взаємодії при переході від гладких до борознистих або пухких в атомному масштабі поверхонь.
Відмінність взаємодії між адатомами від взаємодії між домішковими атомами в об'ємі твердого тіла обумовлена:
1) наявністю поверхневих квазічастин (плазмонів та ін.);
2) асиметрією ефектів екранування;
3) відмінністю спектральної щільності квазічастин на поверхні й в об'ємі.
Крім цього, на поверхні менша енергія активації дифузії, внаслідок чого взаємодія швидше проявляється у взаємному розташуванні адчастинок. Не останню роль відіграє й той факт, що експериментально легше спостерігати положення адатомів, що знаходяться на поверхні, ніж домішкових атомів в об'ємі твердого тіла.
2.5 Хімічна адсорбція як хімічний зв’язок.
Розглянемо в якості адсорбата одновалентний атом [9]. Позначимо його символом А. Як адсорбент будемо розглядати іонний кристал.
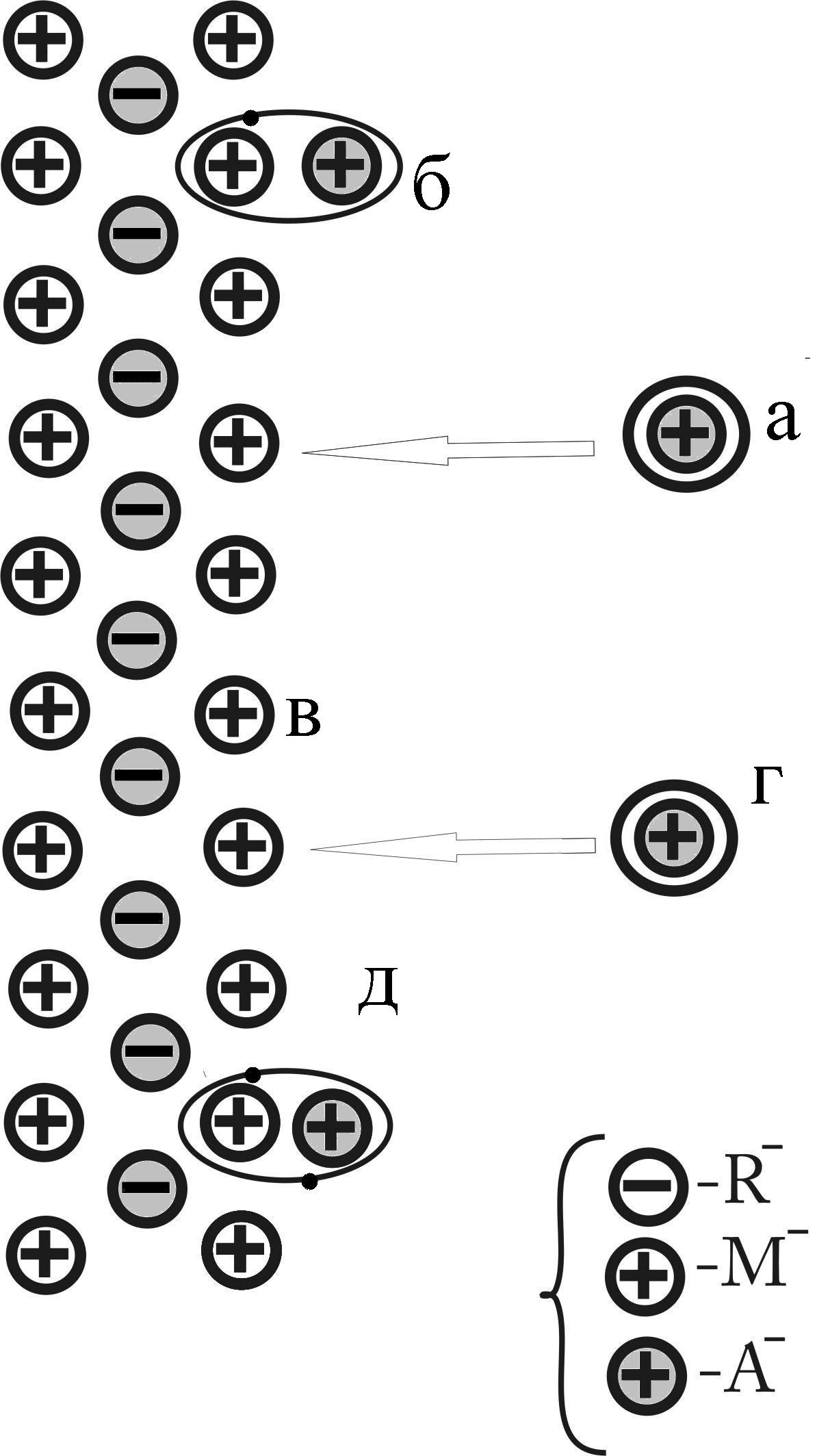
Рис. 2.1. Модель взаємодії одновалентного атома з іонним кристалом.
У такій моделі ми маємо справу з одноелектронною задачею. Єдиний електрон — це валентний електрон атома А. Поки атом А перебуває досить далеко від поверхні кристалу, наш електрон є власністю тільки цього атома (рис. 2.1, а ). Якщо ж атом А адсорбований на поверхні, то його електрон належить тепер не тільки йому. Він належить всій системі в цілому. Валентний електрон атома А може бути при цьому в більшій або меншій мірі затягнутим з атома А в гратку кристалу. Інакше кажучи, електронна хмара, що володіла, у випадку ізольованого атома, сферичною симетрією, тепер деформованою і до деякої міри затягнутою у решітку.
Цим затягуванням електронної хмари у гратку обумовлюється зв'язок між адсорбованим атомом А і кристалом. Таким чином, зв'язок здійснюється за рахунок валентного електрона атома А ми одержуємо зв'язок того ж типу, як у молекулярному іоні. Це - одноелектронний зв'язок б ( рис. 2.1, б).
Міцність зв'язку атома А з поверхнею залежить від того, наскільки сильно затягнутий валентний електрон атома А в гратку. Чим сильніше затягування, тим міцніший зв'язок.
Ступінь затягування визначається природою атома А і природою гратки.
За інших рівних умов це залежить від того, наскільки відрізняються іонізаційні потенціали адсорбованого атома А і атома металу, що входить до складу гратки кристала. У деяких випадках такий одноелектронний зв'язок з граткою виявляється досить слабким.
Якщо одноелектронний зв'язок настільки слабкий, що адсорбція, обумовлена таким зв'язком, практично не здійснюється, то у цьому випадку на допомогу можуть прийти вільні електрони самої кристалічної гратки. Вільні електрони, які утворюють електронний газ, обов'язково присутні у тій або іншій концентрації у будь-якому кристалі. Мова йде про електрони, що мігрують в зоні провідності. Інакше кажучи, мова йде про електронний газ на поверхні кристала.
Концентрація цього газу різко зростає з ростом температури [7]. Її можна штучно змінювати (збільшувати або зменшувати), так чи інакше впливаючи на кристал. Наприклад, вводячи в кристал сторонні домішки, створюючи в ньому ті або інші мікроскопічні дефекти, піддаючи його дії світла.
Наявність таких вільних електронів на поверхні кристала відіграє значну роль у явищах адсорбції.
Їхня роль є вирішальною в тих випадках, коли одноелектронна адсорбція практично не здійснюється завдяки слабкому одноелектронному зв'язку. У цьому випадку адсорбція може бути здійснена тільки за рахунок участі вільного електрона самої гратки.
