
- •Методическое пособие для студентов нехимических специальностей заочного отделения
- •Подготовлено к печати на кафедре органической химии
- •Редактор
- •1. Введение
- •Свойства ковалентной связи.
- •Понятие об индуктивном и мезомерном эффектах
- •Классификация органических реагентов и реакций.
- •2. Номенклатура органических соединений
- •3. Углеводороды
- •3.1. Алканы (предельные, насыщенные углеводороды)
- •3.1.1. Методы получения алканов.
- •3.1.2. Химические свойства алканов
- •Реакции замещения
- •3.2 Циклоалканы
- •Непредельные или ненасыщенные углеводороды
- •3.3 Алкены
- •3.3.1.Методы получения
- •3.3.2.Химические свойства алкенов
- •3.4. Алкадиены.
- •3.5. Алкины.
- •3.5.1.Химические свойства алкинов
- •Как и в случае алкенов реакция идет в присутствии катализаторов (Pt, Pd, Ni и др.) и может быть остановлена на стадии образования алкена.
- •3.6. Реакция полимеризации алкенов и алкадиенов (синтез высокомолекулярных соединений).
- •4. Функциональные производные углеводородов.
- •4.1. Галогенопроизводные.
- •4.1.1. Методы получения и химические свойства галогенопроизводных.
- •5. Кислородосодержащие соединения.
- •5.1. Алканолы (спирты).
- •5.1.1 . Получение спиртов.
- •5.1.2. Химические свойства спиртов.
- •Реакция со щелочными металлами
- •5.2. Альдегиды, кетоны, карбоновые кислоты.
- •5.2.1. Методы получения альдегидов, кетонов, карбоновых кислот.
- •5.2.2. Химические свойства альдегидов и кетонов.
- •5.2.3. Химические свойства карбоновых кислот
- •6. Азотосодержащие производные углеводородов
- •6.1. Алифатические нитросоединения.
- •6.2. Алифатические амины.
- •6.2.1. Химические свойства аминов
- •Основные свойства
- •6.3. Аминокислоты и их производные.
- •6.3.1. Полиамидные волокна.
- •7. Изомерия органических соединений
- •Структурная изомерия
- •Пространственная изомерия
- •8. Сахариды (углеводы)
- •8.1.Моносахариды
- •8.1.1 Строение, изомерия
- •8.1.2. Химические свойства моносахаридов
- •8.2. Полисахариды
- •9. Арены. Ароматические углеводороды и их производные.
- •9.1. Бензол и его производные. Строение, изомерия.
- •9.1.1. Методы получения углеводородов ряда бензола.
- •9.1.2. Химические свойства углеводородов ряда бензола.
- •Электрофильное замещение.
- •Влияние заместителей в бензольном ядре на реакцию электрофильного замещения.
- •9.3. Ароматические амины.
- •9.3.1. Химические свойства аминов
- •Реакции аминогруппы.
- •Реакции ароматического ядра.
- •9.4. Ароматические азо- и диазосоединения. Азокрасители.
- •9.4.1. Химические свойства солей диазония
- •Реакции с выделением азота.
- •Реакции без выделения азота.
- •Контрольная работа №1.
- •Вариант №1
- •Контрольная работа № 2.
- •Содержание
- •1. Введение…………………………………………….……………...3
5. Кислородосодержащие соединения.
5.1. Алканолы (спирты).
Алканолами (спиртами) называют гидроксилсодержащие производные углеводородов. Предельные одноатомные спирты имеют общую формулу CnH2n-1OH.
В зависимости от того, при каком углеродном атоме (первичном, вторичном или третичном) находится гидроксильная группа, соответственно различают первичные CH3CH2OH (I), вторичные CH3CHOH-CH3 (II), третичные (CH3)3COH (III) спирты.
В основе названия алканолов – название углеводородного радикала, связанного с гидроксильной группой с добавлением окончания –ол.
I – этанол, II – пропан–2–ол, III – 2–метилпропан–2–ол.
5.1.1 . Получение спиртов.
Спирты в количестве тысяч тонн используются в различных отраслях промышленности: производство пластмасс, синтетических волокон, пищевой, косметической и т.д.
Природные источники не могут удовлетворить потребность в спиртах, поэтому основные методы их получения – синтетические: из алкенов (см. гл. 3.3), из галогенпроизводных (см. гл. 4.1), и др.
5.1.2. Химические свойства спиртов.
Химические свойства спиртов обусловлены присутствием реакционноспособной гидроксильной группы – OH. Реакции проходят с разрывом связи O – H, либо С – О.
Реакция со щелочными металлами
![]()
Реакция этерификации.
Спирты взаимодействуют с минеральными и органическими кислотами с образованием сложных эфиров.
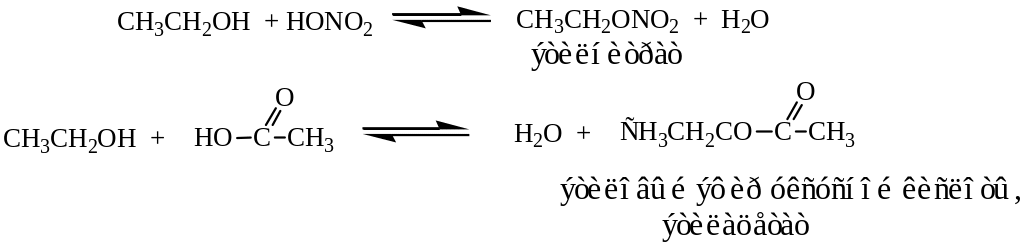
Дегидратация.
При действии водоотнимающих средств, в зависимости от условий процесса, реакция происходит по разным схемам.
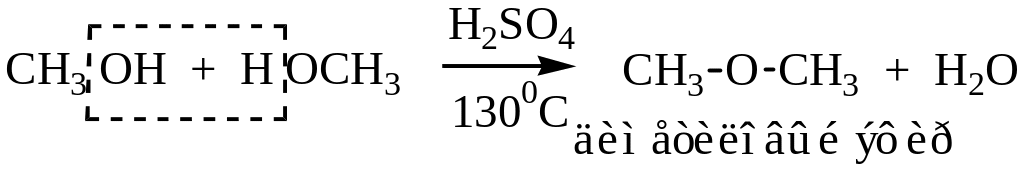
При межмолекулярной дегидратации спиртов образуются простые эфиры.
При внутримолекулярной дегидратации спиртов образуются непредельные углеводороды.
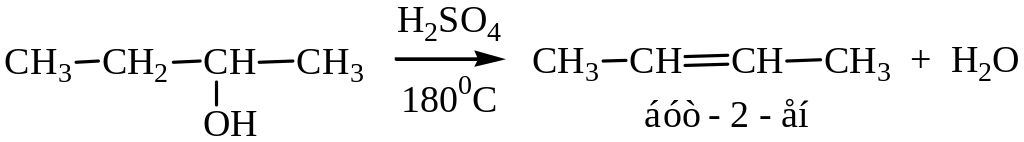
Отщепление идет по правилу Зайцева, (см. гл. 3.1.)
Замещение гидроксильной группы на атом галогена.
В качестве реагентов используются галогенводородные кислоты, галогениды фосфора и др.
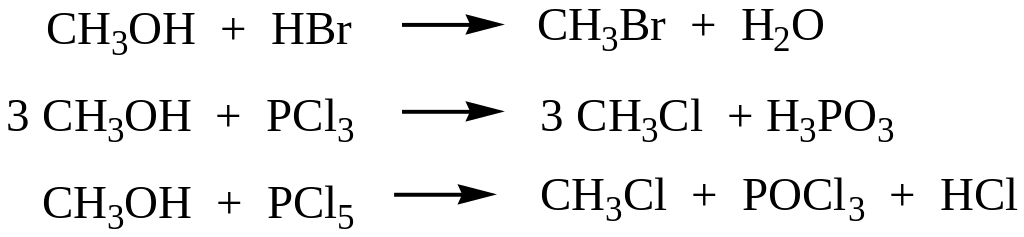
Окисление.
Спирты окисляются действием различных окислителей, в зависимости от строения и условий реакции образуются различные продукты: альдегиды, кетоны, карбоновые кислоты, углекислый газ (реакция горения).
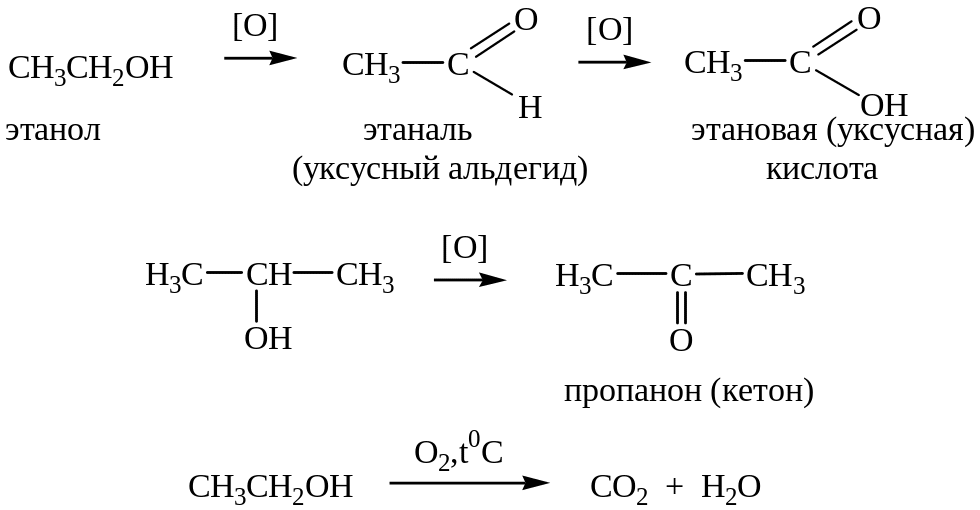
(при сгорании выделяется большое количество тепла. Спирты используются в качестве горючего).
5.2. Альдегиды, кетоны, карбоновые кислоты.
А![]() льдегиды
и кетоны – производные углеводородов,
в молекулах которых имеется карбонильная
группа.
льдегиды
и кетоны – производные углеводородов,
в молекулах которых имеется карбонильная
группа.
Отличие в строении заключается в том, что в случае альдегидов у атома углерода карбонильной группы обязательно имеется атом водорода, а у кетонов с карбонильным углеродом связаны два органических радикала.

Название по номенклатуре ИЮПАК определяется названием алкана с тем же числом атомов углерода, к которому в случае альдегидов добавляется окончание – аль, а в случае кетонов – он.
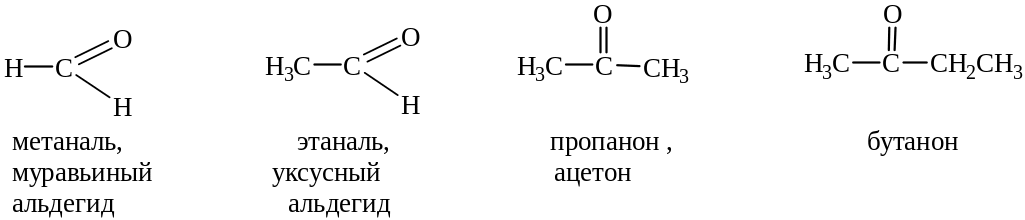
Некоторые простые представители называют часто по тривиальной номенклатуре, например, муравьиный и уксусный альдегид, ацетон.
Карбоновые кислоты – производные
углеводородов, содержащие карбоксильную
группу
![]() .
.
В зависимости от числа карбоксильных групп различают одноосновные, двухосновные и т. д. кислоты, а в зависимости от строения углеводородного радикала насыщенные, ненасыщенные и т.д. кислоты.
Название карбоновой кислоты обусловлено названием соответствующего углеводорода и окончанием –овая кислота.
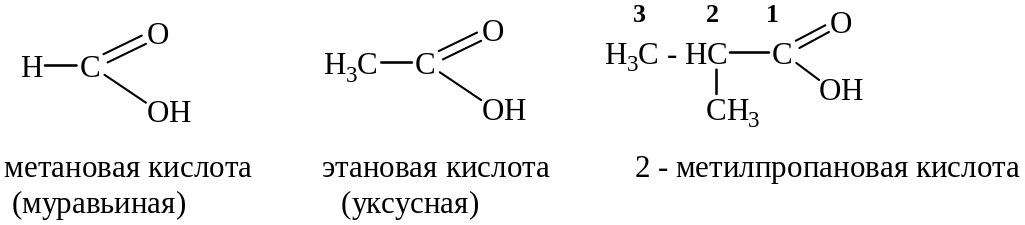
Для некоторых кислот сохраняются тривиальные названия: муравьиная, уксусная и др.
