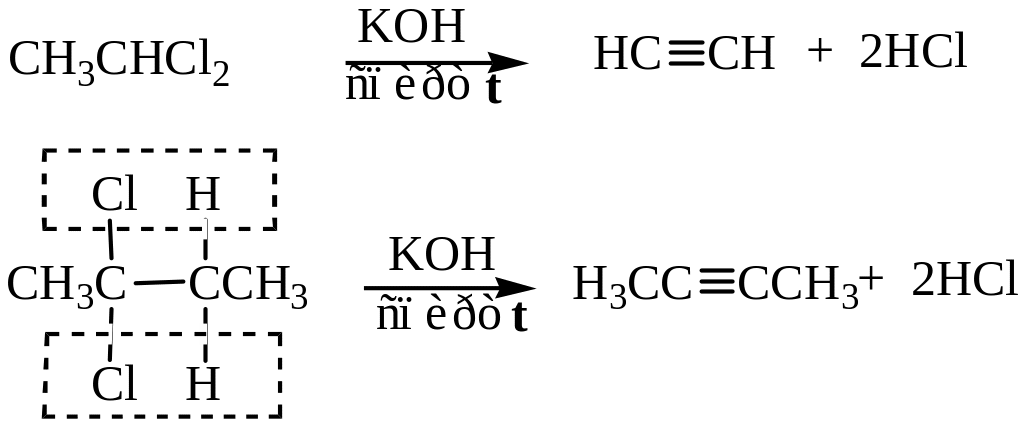- •Методическое пособие для студентов нехимических специальностей заочного отделения
- •Подготовлено к печати на кафедре органической химии
- •Редактор
- •1. Введение
- •Свойства ковалентной связи.
- •Понятие об индуктивном и мезомерном эффектах
- •Классификация органических реагентов и реакций.
- •2. Номенклатура органических соединений
- •3. Углеводороды
- •3.1. Алканы (предельные, насыщенные углеводороды)
- •3.1.1. Методы получения алканов.
- •3.1.2. Химические свойства алканов
- •Реакции замещения
- •3.2 Циклоалканы
- •Непредельные или ненасыщенные углеводороды
- •3.3 Алкены
- •3.3.1.Методы получения
- •3.3.2.Химические свойства алкенов
- •3.4. Алкадиены.
- •3.5. Алкины.
- •3.5.1.Химические свойства алкинов
- •Как и в случае алкенов реакция идет в присутствии катализаторов (Pt, Pd, Ni и др.) и может быть остановлена на стадии образования алкена.
- •3.6. Реакция полимеризации алкенов и алкадиенов (синтез высокомолекулярных соединений).
- •4. Функциональные производные углеводородов.
- •4.1. Галогенопроизводные.
- •4.1.1. Методы получения и химические свойства галогенопроизводных.
- •5. Кислородосодержащие соединения.
- •5.1. Алканолы (спирты).
- •5.1.1 . Получение спиртов.
- •5.1.2. Химические свойства спиртов.
- •Реакция со щелочными металлами
- •5.2. Альдегиды, кетоны, карбоновые кислоты.
- •5.2.1. Методы получения альдегидов, кетонов, карбоновых кислот.
- •5.2.2. Химические свойства альдегидов и кетонов.
- •5.2.3. Химические свойства карбоновых кислот
- •6. Азотосодержащие производные углеводородов
- •6.1. Алифатические нитросоединения.
- •6.2. Алифатические амины.
- •6.2.1. Химические свойства аминов
- •Основные свойства
- •6.3. Аминокислоты и их производные.
- •6.3.1. Полиамидные волокна.
- •7. Изомерия органических соединений
- •Структурная изомерия
- •Пространственная изомерия
- •8. Сахариды (углеводы)
- •8.1.Моносахариды
- •8.1.1 Строение, изомерия
- •8.1.2. Химические свойства моносахаридов
- •8.2. Полисахариды
- •9. Арены. Ароматические углеводороды и их производные.
- •9.1. Бензол и его производные. Строение, изомерия.
- •9.1.1. Методы получения углеводородов ряда бензола.
- •9.1.2. Химические свойства углеводородов ряда бензола.
- •Электрофильное замещение.
- •Влияние заместителей в бензольном ядре на реакцию электрофильного замещения.
- •9.3. Ароматические амины.
- •9.3.1. Химические свойства аминов
- •Реакции аминогруппы.
- •Реакции ароматического ядра.
- •9.4. Ароматические азо- и диазосоединения. Азокрасители.
- •9.4.1. Химические свойства солей диазония
- •Реакции с выделением азота.
- •Реакции без выделения азота.
- •Контрольная работа №1.
- •Вариант №1
- •Контрольная работа № 2.
- •Содержание
- •1. Введение…………………………………………….……………...3
3.5. Алкины.
Гомологический ряд выражен общей формулой CnHn.
Названия ненасыщенных углеводородов с тройной связью образуют, заменяя суффикс -ан в алкане на -ин в алкине.
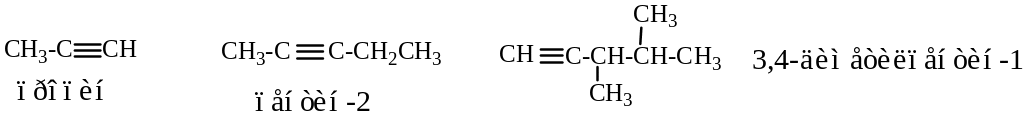
3.5.1.Химические свойства алкинов
Так же как и в алкенах кратная (тройная) связь в алкинах является основным реакционным центром в ряде химических превращений.
Наиболее характерны для алкинов реакции присоединения.
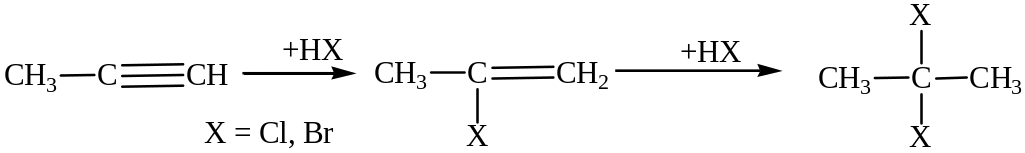
Присоединение галогеноводородов.
Реакция протекает ступенчато. Соблюдается правило Марковникова.
Присоединение галогенов.
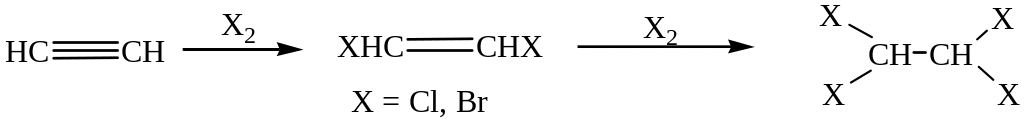
Присоединение воды (реакция Кучерова).
Реакция проходит в присутствии катализатора – сернокислой ртути. На стадии образования винилового спирта соблюдается правило Марковникова.
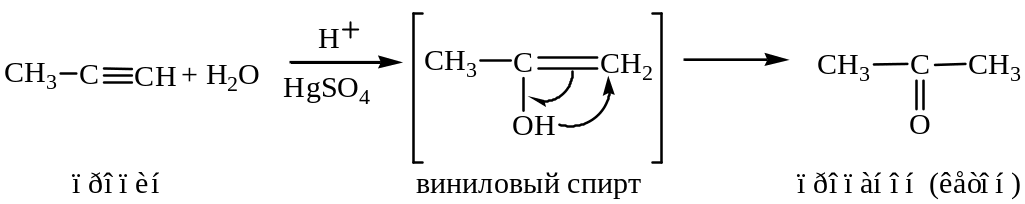
Промежуточно образующееся соединение (виниловый спирт) неустойчиво и изомеризуется в условиях реакции в кетон.
Присоединение водорода (реакция гидрирования).
Как и в случае алкенов реакция идет в присутствии катализаторов (Pt, Pd, Ni и др.) и может быть остановлена на стадии образования алкена.
![]()
3.6. Реакция полимеризации алкенов и алкадиенов (синтез высокомолекулярных соединений).
Принято называть наше время временем полимеров. Сейчас действительно невозможно представить себе современную жизнь, какую-либо отрасль промышленности без изделий из пластических масс, каучуков, синтетических волокон и т.д.
Высокомолекулярные соединения (ВМС) – вещества, молекулы которых состоят из огромного числа атомов, связанных ковалентными связями.
Высокомолекулярные соединения часто называют полимерами (poly-много meros-часть), т.к. они состоят, как правило, из одинаковых, многократно повторяющихся групп атомов- элементарных звеньев- связанных между собой.

Число элементарных звеньев в макромолекуле полимера –(n)- называется степенью полимеризации.
Один из основных способов синтеза ВМС – реакция полимеризации алкенов или алкадиенов.
Реакцию полимеризации можно сформулировать как реакцию соединения молекул мономера, протекающую за счет разрыва кратных связей без выделения низкомолекулярных продуктов.
Разрыв связи в молекулах мономеров (алкенов и алкадиенов) может инициироваться ионными или радикальными инициаторами, различными катализаторами.
Рассмотрим лишь принципиальную схему образования макромолекулы полимера.

Сопряженные алкадиены полимеризуются по схеме 1,2- или 1,4.
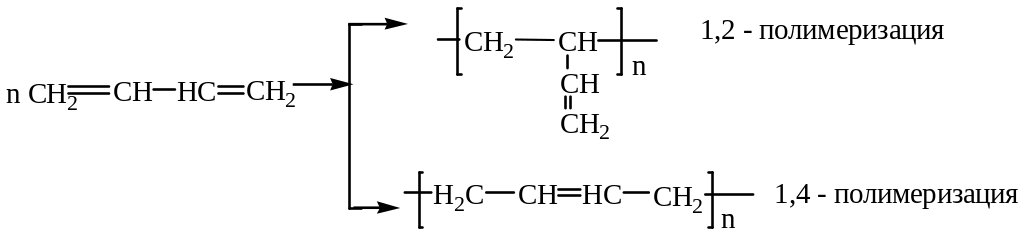
4. Функциональные производные углеводородов.
4.1. Галогенопроизводные.
Галогенопроизводные можно рассматривать как продукты замещения в молекулах углеводородов одного или нескольких атомов водорода атомами галогенов. Моногалогенопроизводные предельных углеводородов называются алкилгалогенидами и имеют общую формулу CnH2n+1 Hal (где Hal = Cl, Br, F, I). В зависимости от того, с каким атомом углерода связан атом галогена, различают первичные CH3CH2Cl (I), вторичные CH3-CHCl-CH3 (II) и третичные CH3-C(CH3)Cl-CH3 (III) галогенопроизводные. Алкилгалогениды называют по радикалу, связанному с галогеном. Названия вышеуказанных алкилгалогенидов I – хлорэтан, II – 2 - хлорпропан, III – 2-хлор-2- метилпропан.
4.1.1. Методы получения и химические свойства галогенопроизводных.
Среди химических соединений, встречающихся в природных источниках, имеются галогенопроизводные, но количества их невелики и они не могут удовлетворить потребности различных отраслей промышленности в производных этого класса.
Галогенопроизводные углеводородов синтезируют различными способами, из которых отметим: получение из алканов (см. гл. 3.1), из алкенов и алкинов (см. гл. 3.3 и 3.5), из спиртов (см. гл. 5.1).
Алкилгалогениды – один из наиболее реакционноспособных классов органических соединений. С их помощью вводят в различные органические соединения алкильные радикалы.
Для алкилгалогенидов наиболее характерны реакции нуклеофильного замещения галогена на различные атомы и группы атомов и отщепления (элиминирования) атомов галогенов.
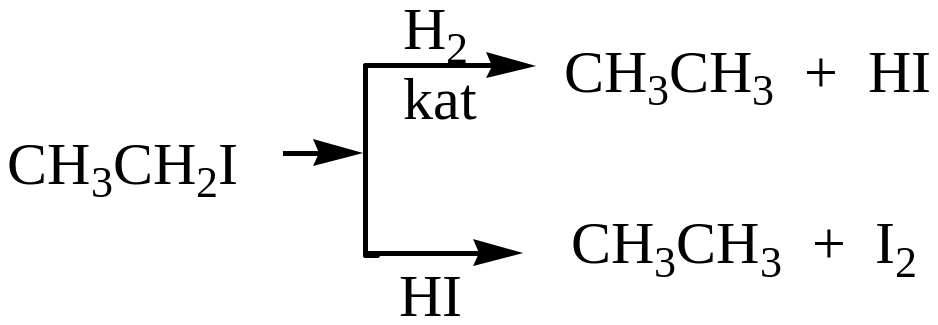
Замещение галогена на атом водорода.
При каталитическом гидрировании галогеналканов, а также действии йодистого водорода, происходит замещение атома галогена на водород.
Замещение галогена на гидроксильную группу (гидролиз).
![]()
Замещение галогена на аминогруппу (получение аминов).

Замещение галогена на группу CN.
Пользуясь этой реакцией можно перейти от алканов к карбоновым кислотам.
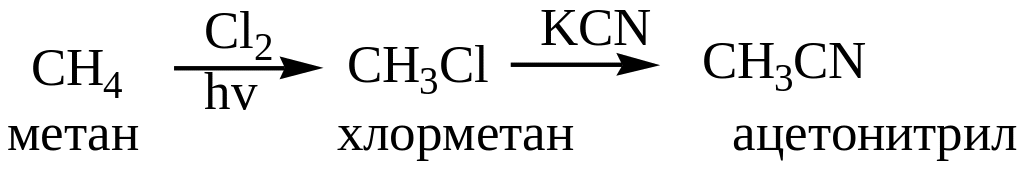
![]()
Замещение галогена на атом металла.
![]()
Натрий алкил вступает далее в реакцию с избытком алкилгалогенида с образованием алкана
![]()
Эта реакция является способом получения предельных углеводородов из соединений с меньшим числом углеродных атомов.
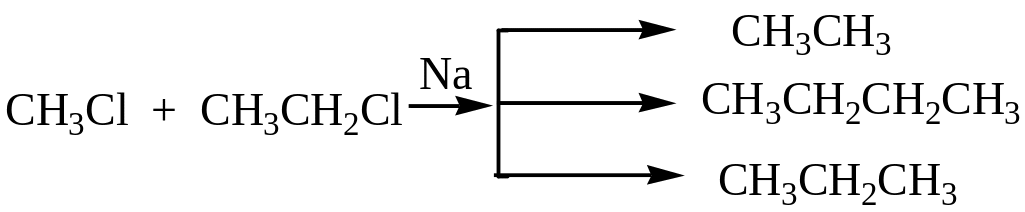
Синтез Вюрца.
![]()
Особенностью синтеза Вюрца является то, что в случае использования в качестве исходных веществ различных алкилгалогенидов в результате реакции получается смесь углеводородов:
Реакция отщепления.
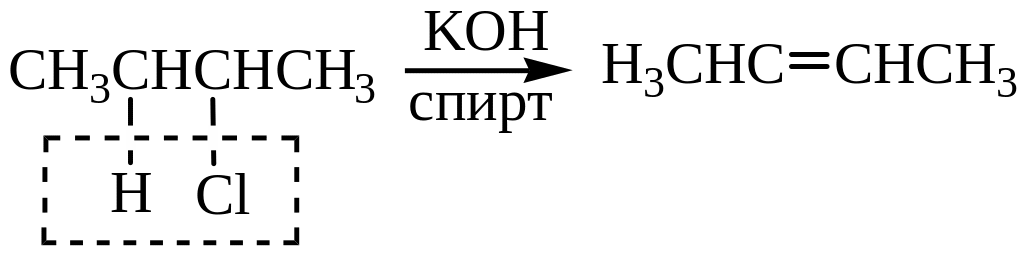
При действии спиртового раствора едких щелочей алкилгалогениды отщепляют галогеноводород с образованием алкенов.
Отщепление идет согласно правилу Зайцева: наиболее легко отщепляется водород от соседнего наименее гидрогенизированного атома углерода. Этот водород наиболее подвижен.
Из дигалогенопроизводных можно получить алкины.