
- •Методическое пособие для студентов нехимических специальностей заочного отделения
- •Подготовлено к печати на кафедре органической химии
- •Редактор
- •1. Введение
- •Свойства ковалентной связи.
- •Понятие об индуктивном и мезомерном эффектах
- •Классификация органических реагентов и реакций.
- •2. Номенклатура органических соединений
- •3. Углеводороды
- •3.1. Алканы (предельные, насыщенные углеводороды)
- •3.1.1. Методы получения алканов.
- •3.1.2. Химические свойства алканов
- •Реакции замещения
- •3.2 Циклоалканы
- •Непредельные или ненасыщенные углеводороды
- •3.3 Алкены
- •3.3.1.Методы получения
- •3.3.2.Химические свойства алкенов
- •3.4. Алкадиены.
- •3.5. Алкины.
- •3.5.1.Химические свойства алкинов
- •Как и в случае алкенов реакция идет в присутствии катализаторов (Pt, Pd, Ni и др.) и может быть остановлена на стадии образования алкена.
- •3.6. Реакция полимеризации алкенов и алкадиенов (синтез высокомолекулярных соединений).
- •4. Функциональные производные углеводородов.
- •4.1. Галогенопроизводные.
- •4.1.1. Методы получения и химические свойства галогенопроизводных.
- •5. Кислородосодержащие соединения.
- •5.1. Алканолы (спирты).
- •5.1.1 . Получение спиртов.
- •5.1.2. Химические свойства спиртов.
- •Реакция со щелочными металлами
- •5.2. Альдегиды, кетоны, карбоновые кислоты.
- •5.2.1. Методы получения альдегидов, кетонов, карбоновых кислот.
- •5.2.2. Химические свойства альдегидов и кетонов.
- •5.2.3. Химические свойства карбоновых кислот
- •6. Азотосодержащие производные углеводородов
- •6.1. Алифатические нитросоединения.
- •6.2. Алифатические амины.
- •6.2.1. Химические свойства аминов
- •Основные свойства
- •6.3. Аминокислоты и их производные.
- •6.3.1. Полиамидные волокна.
- •7. Изомерия органических соединений
- •Структурная изомерия
- •Пространственная изомерия
- •8. Сахариды (углеводы)
- •8.1.Моносахариды
- •8.1.1 Строение, изомерия
- •8.1.2. Химические свойства моносахаридов
- •8.2. Полисахариды
- •9. Арены. Ароматические углеводороды и их производные.
- •9.1. Бензол и его производные. Строение, изомерия.
- •9.1.1. Методы получения углеводородов ряда бензола.
- •9.1.2. Химические свойства углеводородов ряда бензола.
- •Электрофильное замещение.
- •Влияние заместителей в бензольном ядре на реакцию электрофильного замещения.
- •9.3. Ароматические амины.
- •9.3.1. Химические свойства аминов
- •Реакции аминогруппы.
- •Реакции ароматического ядра.
- •9.4. Ароматические азо- и диазосоединения. Азокрасители.
- •9.4.1. Химические свойства солей диазония
- •Реакции с выделением азота.
- •Реакции без выделения азота.
- •Контрольная работа №1.
- •Вариант №1
- •Контрольная работа № 2.
- •Содержание
- •1. Введение…………………………………………….……………...3
3.1.1. Методы получения алканов.
1) Основной источник промышленного получения алканов – нефть и продукты ее переработки. Алканы получают также из каменного и бурого угля, сланцев, природного газа.
2) Перспективен путь получения простейших алканов из СО и Н2
![]()
3) Методы получения, основанные на превращениях функциональных групп, рассматриваются в соответствующих разделах курса. Например, из алкенов (см. гл. 3.3), алкинов (см. гл. 3.5), из алкилгалогенидов (см. гл. 4.1).
![]()
3.1.2. Химические свойства алканов
Химические превращения предельных углеводородов происходят в основном за счет разрыва цепи углеродных атомов, отрыва атомов водорода или замещения их другими атомами или группами.
Для алканов характерны реакции замещения и отщепления. Реакции замещения наиболее легко идут у третичного углеродного атома.
Реакции замещения
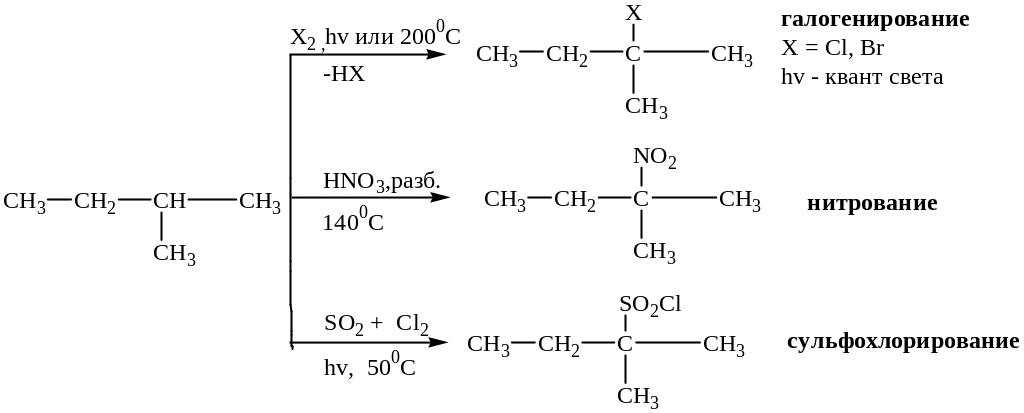
Приведенные выше реакции являются примерами радикальных цепных реакций в органической химии.
Рассмотрим механизм таких реакций на примере реакции хлорирования.
На свету или при нагревании молекула хлора распадается на два радикала, под действием которых происходит замещение атомов водорода.
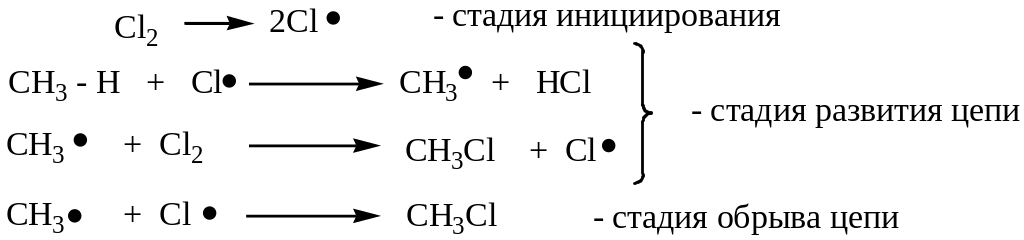
Окисление.
Кислород воздуха в присутствии катализаторов, а также некоторые окислители (KМnO4, K2Cr2O7 и др.) окисляют алканы при повышенных температурах с разрывом цепи и образованием органических кислот.
![]()
При высоких температурах алканы сгорают с выделением тепла до двуокиси углерода и воды. На этой реакции основано использование алканов в качестве топлива.
![]()
Реакции отщепления.
Отщепление водорода (дегидрирование)
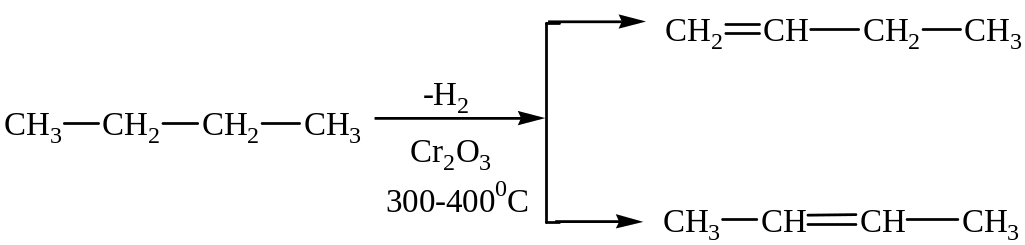
Крекинг алканов (расщепление С–С – связи)
Реакция осуществляется либо действием высоких температур (термический крекинг), либо под влиянием катализаторов (каталитический крекинг), что позволяет снизить температуру процесса в 2-3 раза.
Пример термического крекинга.

3.2 Циклоалканы
Циклоалканами называются предельные углеводороды, содержащие замкнутые циклы из атомов углерода с общей формулой CnH2n, где n ≥ 3. К названию алкана прибавляется приставка цикло-.
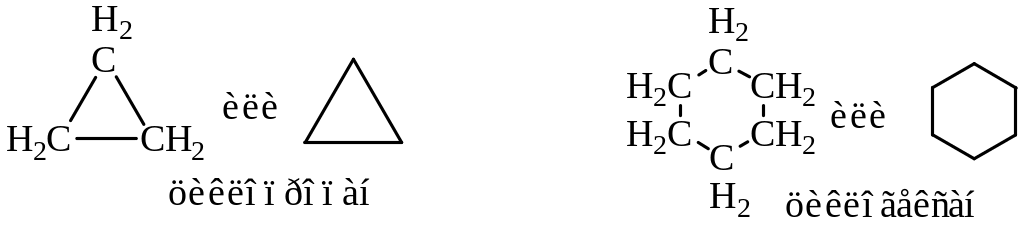
Циклоалканы, также как и алканы, легко вступают в радикальные реакции, например, с галогенами, азотной кислотой.

Исключение составляют низшие циклоалканы (циклопропан, циклобутан), которые при гидрировании и галогенировании вследствие особых свойств малых циклов (высокая напряженность) вступают в реакцию с раскрытием цикла.

Непредельные или ненасыщенные углеводороды
Углеводороды, в молекуле которых помимо простых (одинарных) σ – связей (С – С и С – Н) имеются углерод – углеродные π – связи (двойные и тройные), называются непредельными или ненасыщенными.
Поскольку π – связь менее прочная чем σ – связь, она легко разрывается под действием различных реагентов с образованием двух σ – связей. Таким образом, для ненасыщенных соединений наиболее характерны реакции присоединения.
Из непредельных соединений ниже будут рассмотрены следующие группы:
Алкены – содержат одну двойную связь
Алкадиены – содержат две двойные связи
Алкины – содержат тройную связь.
В ненасыщенных углеводородах структурная изомерия обусловлена не только изомерией углеводородной цепи, но и положением двойной или тройной связи. Структурные изомеры:
![]()
