- •Методическое пособие для студентов нехимических специальностей заочного отделения
- •Подготовлено к печати на кафедре органической химии
- •Редактор
- •1. Введение
- •Свойства ковалентной связи.
- •Понятие об индуктивном и мезомерном эффектах
- •Классификация органических реагентов и реакций.
- •2. Номенклатура органических соединений
- •3. Углеводороды
- •3.1. Алканы (предельные, насыщенные углеводороды)
- •3.1.1. Методы получения алканов.
- •3.1.2. Химические свойства алканов
- •Реакции замещения
- •3.2 Циклоалканы
- •Непредельные или ненасыщенные углеводороды
- •3.3 Алкены
- •3.3.1.Методы получения
- •3.3.2.Химические свойства алкенов
- •3.4. Алкадиены.
- •3.5. Алкины.
- •3.5.1.Химические свойства алкинов
- •Как и в случае алкенов реакция идет в присутствии катализаторов (Pt, Pd, Ni и др.) и может быть остановлена на стадии образования алкена.
- •3.6. Реакция полимеризации алкенов и алкадиенов (синтез высокомолекулярных соединений).
- •4. Функциональные производные углеводородов.
- •4.1. Галогенопроизводные.
- •4.1.1. Методы получения и химические свойства галогенопроизводных.
- •5. Кислородосодержащие соединения.
- •5.1. Алканолы (спирты).
- •5.1.1 . Получение спиртов.
- •5.1.2. Химические свойства спиртов.
- •Реакция со щелочными металлами
- •5.2. Альдегиды, кетоны, карбоновые кислоты.
- •5.2.1. Методы получения альдегидов, кетонов, карбоновых кислот.
- •5.2.2. Химические свойства альдегидов и кетонов.
- •5.2.3. Химические свойства карбоновых кислот
- •6. Азотосодержащие производные углеводородов
- •6.1. Алифатические нитросоединения.
- •6.2. Алифатические амины.
- •6.2.1. Химические свойства аминов
- •Основные свойства
- •6.3. Аминокислоты и их производные.
- •6.3.1. Полиамидные волокна.
- •7. Изомерия органических соединений
- •Структурная изомерия
- •Пространственная изомерия
- •8. Сахариды (углеводы)
- •8.1.Моносахариды
- •8.1.1 Строение, изомерия
- •8.1.2. Химические свойства моносахаридов
- •8.2. Полисахариды
- •9. Арены. Ароматические углеводороды и их производные.
- •9.1. Бензол и его производные. Строение, изомерия.
- •9.1.1. Методы получения углеводородов ряда бензола.
- •9.1.2. Химические свойства углеводородов ряда бензола.
- •Электрофильное замещение.
- •Влияние заместителей в бензольном ядре на реакцию электрофильного замещения.
- •9.3. Ароматические амины.
- •9.3.1. Химические свойства аминов
- •Реакции аминогруппы.
- •Реакции ароматического ядра.
- •9.4. Ароматические азо- и диазосоединения. Азокрасители.
- •9.4.1. Химические свойства солей диазония
- •Реакции с выделением азота.
- •Реакции без выделения азота.
- •Контрольная работа №1.
- •Вариант №1
- •Контрольная работа № 2.
- •Содержание
- •1. Введение…………………………………………….……………...3
9.1.1. Методы получения углеводородов ряда бензола.
Основной источник углеводородов этого ряда – нефть и продукты её переработки, из которых бензол и его гомологи выделяют ректификацией (перегонкой). Источниками углеводородов ряда бензола являются также продукты переработки угля, сланцев.
Синтетически получают только производные, содержащие функциональные группы (NO2, Cl, CN и т. д.), т. к. их количества в продуктах природного происхождения весьма незначительны и не могут удовлетворить потребности промышленности.
9.1.2. Химические свойства углеводородов ряда бензола.
Особенности химического строения углеводородов ряда бензола (ароматичность) обуславливают специфику его химических свойств.
Несмотря на формальную ненасыщенность наиболее характерны для бензола не реакции присоединения, а реакции замещения (электрофильного).
Электрофильное замещение.
Реакция электрофильного замещения в ряду бензола заключается в атаке электрофильного реагента на -электронную систему бензольного ядра. В первый период реакции электрофильный реагент фиксируется около молекулы с повышенной электронной плотностью не связываясь с каким-либо конкретным атомом углерода. Эта стадия обратима, называется стадией образования -комплекса. Если условия реакции позволяют (температура, термодинамический и кинетический факторы и т. д.), электрофильная частица «вытягивает» из шестиэлектронной системы пару электронов, образуется истинная -связь между атомом углерода бензольного ядра и атомом электрофила, это, так называемый, -комплекс, в котором возникающий в кольце положительный заряд не зафиксирован на каком-либо конкретном атоме углерода. На последней стадии происходит выброс протона (Н+) и возвращение к энергетически выгодной ароматической системе.
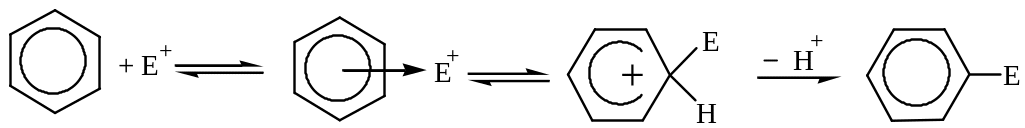
электрофил π-комплекс σ-комплекс
Ниже приведены наиболее типичные и важные реакции электрофильного замещения в молекуле бензола.
Приведенные схемы не объясняют электрофильного характера реагента. Ниже в общем виде для указанных реакций даны такие объяснения.
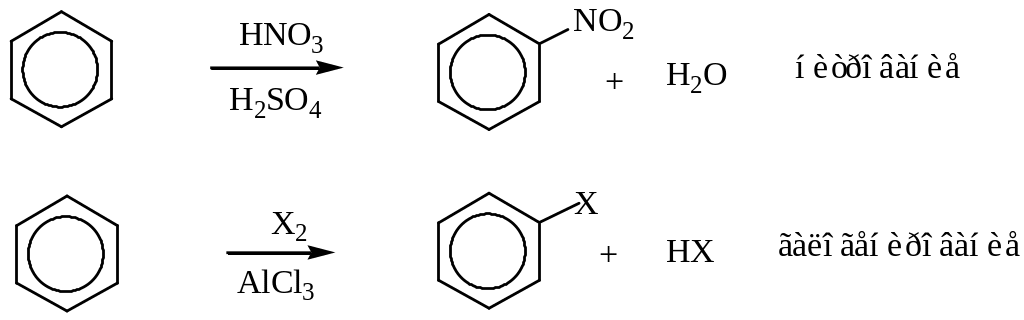
Нитрование осуществляется обычно смесью азотной и серной кислот, при взаимодействии которых и образуется нитрующий агент – катион нитрония NO2+.
![]()
Образовавшийся ион атакует ароматическое ядро, образуя нитрозамещенное ароматическое соединение.
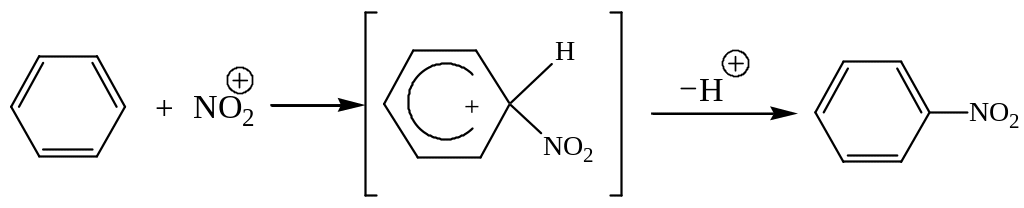
нитробензол
Галогенирование проводится действием галогена в присутствии катализатора, в качестве которого используются галогениды металлов (FeBr3, AlCl3). Их каталитическая активность связана со способностью поляризовать связь галоген-галоген.
![]()
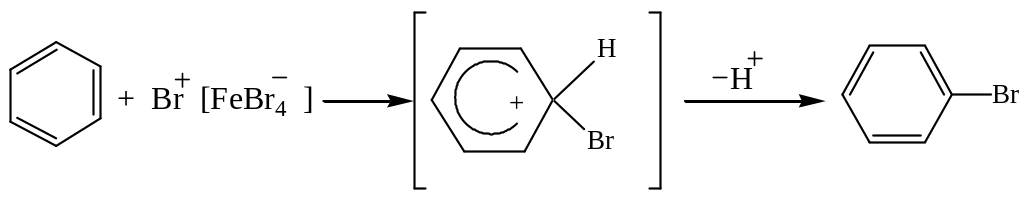
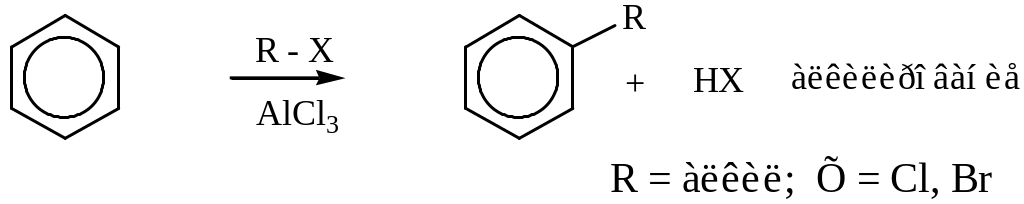
Алкилирование – важнейший метод синтеза алкилбензолов состоит в действии на ароматическое соединение алкилгалогенида в присутствии катализатора – галогенида металла (хлористого алюминия).
Э
+
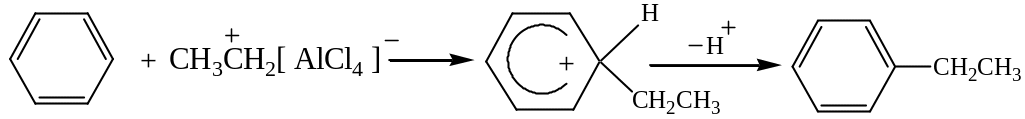
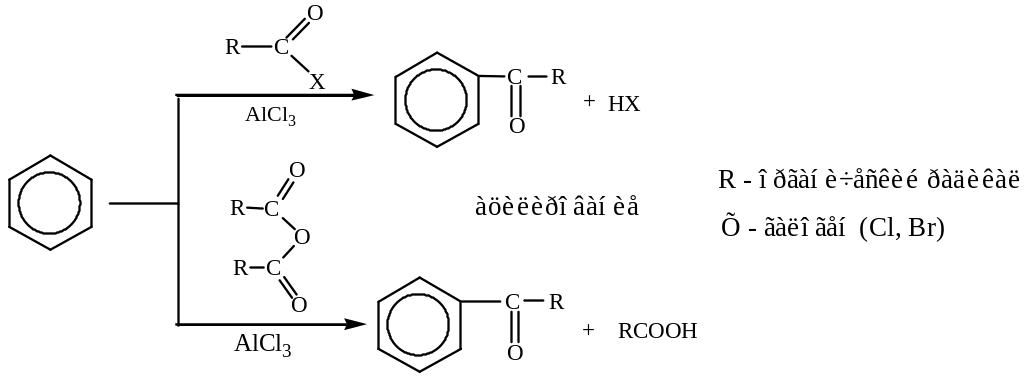
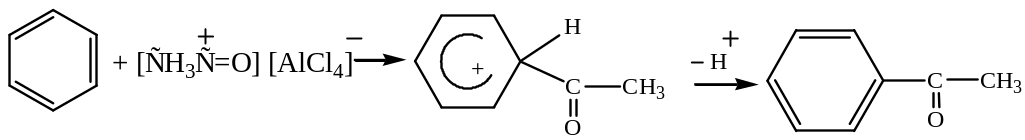
Ацилирование основано на реакции галогенангидрида или ангидрида карбоновой кислоты в присутствии катализатора, например, AlCl3.
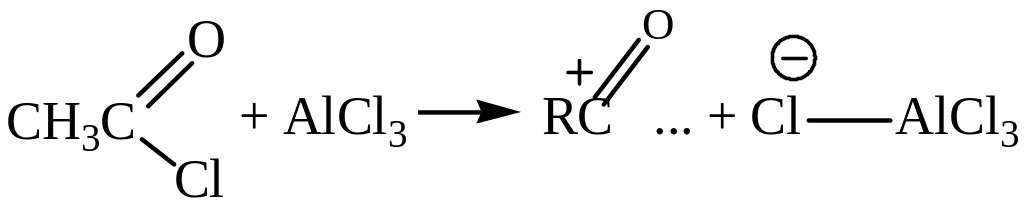
В результате ацилирования по Фриделю-Крафтсу образуются ароматические кетоны
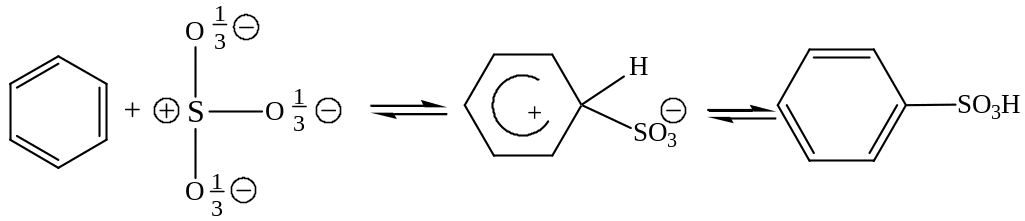
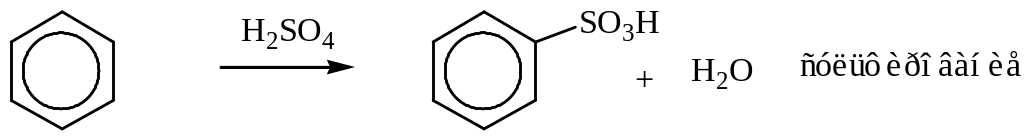
Сульфирование. Замещение атома водорода на остаток серной кислоты (─SO3H) происходит при нагревании аренов с небольшим избытком концентрированной или дымящей серной кислоты.
Сульфирующим агентом является нейтральная молекула SO3, в которой атом серы обладает свойствами сильного электрофила.