- •Методическое пособие для студентов нехимических специальностей заочного отделения
- •Подготовлено к печати на кафедре органической химии
- •Редактор
- •1. Введение
- •Свойства ковалентной связи.
- •Понятие об индуктивном и мезомерном эффектах
- •Классификация органических реагентов и реакций.
- •2. Номенклатура органических соединений
- •3. Углеводороды
- •3.1. Алканы (предельные, насыщенные углеводороды)
- •3.1.1. Методы получения алканов.
- •3.1.2. Химические свойства алканов
- •Реакции замещения
- •3.2 Циклоалканы
- •Непредельные или ненасыщенные углеводороды
- •3.3 Алкены
- •3.3.1.Методы получения
- •3.3.2.Химические свойства алкенов
- •3.4. Алкадиены.
- •3.5. Алкины.
- •3.5.1.Химические свойства алкинов
- •Как и в случае алкенов реакция идет в присутствии катализаторов (Pt, Pd, Ni и др.) и может быть остановлена на стадии образования алкена.
- •3.6. Реакция полимеризации алкенов и алкадиенов (синтез высокомолекулярных соединений).
- •4. Функциональные производные углеводородов.
- •4.1. Галогенопроизводные.
- •4.1.1. Методы получения и химические свойства галогенопроизводных.
- •5. Кислородосодержащие соединения.
- •5.1. Алканолы (спирты).
- •5.1.1 . Получение спиртов.
- •5.1.2. Химические свойства спиртов.
- •Реакция со щелочными металлами
- •5.2. Альдегиды, кетоны, карбоновые кислоты.
- •5.2.1. Методы получения альдегидов, кетонов, карбоновых кислот.
- •5.2.2. Химические свойства альдегидов и кетонов.
- •5.2.3. Химические свойства карбоновых кислот
- •6. Азотосодержащие производные углеводородов
- •6.1. Алифатические нитросоединения.
- •6.2. Алифатические амины.
- •6.2.1. Химические свойства аминов
- •Основные свойства
- •6.3. Аминокислоты и их производные.
- •6.3.1. Полиамидные волокна.
- •7. Изомерия органических соединений
- •Структурная изомерия
- •Пространственная изомерия
- •8. Сахариды (углеводы)
- •8.1.Моносахариды
- •8.1.1 Строение, изомерия
- •8.1.2. Химические свойства моносахаридов
- •8.2. Полисахариды
- •9. Арены. Ароматические углеводороды и их производные.
- •9.1. Бензол и его производные. Строение, изомерия.
- •9.1.1. Методы получения углеводородов ряда бензола.
- •9.1.2. Химические свойства углеводородов ряда бензола.
- •Электрофильное замещение.
- •Влияние заместителей в бензольном ядре на реакцию электрофильного замещения.
- •9.3. Ароматические амины.
- •9.3.1. Химические свойства аминов
- •Реакции аминогруппы.
- •Реакции ароматического ядра.
- •9.4. Ароматические азо- и диазосоединения. Азокрасители.
- •9.4.1. Химические свойства солей диазония
- •Реакции с выделением азота.
- •Реакции без выделения азота.
- •Контрольная работа №1.
- •Вариант №1
- •Контрольная работа № 2.
- •Содержание
- •1. Введение…………………………………………….……………...3
8.2. Полисахариды
Полисахариды представляют собой природные полимеры, которые по структурной формуле являются продуктами поликонденсации моносахаридов.
Наиболее распространены в природе полисахариды крахмал и целлюлоза.
Крахмал образуется в растениях при фотосинтезе и откладывается в корнях и семенах. Он представляет собой белый порошок, нерастворимый в холодной воде и образующий коллоидный раствор в горячей воде.
Крахмал – это природный полимер, состоящий из остатков α–D–глюкопиранозы. Он существует в двух формах: амилоза и амилопектин. Амилоза растворима в воде и представляет собой линейный полимер, в котором остатки α – D – глюкозы связаны друг с другом через первый и четвертый атомы углерода.
Фрагмент амилозы выглядит следующим образом:
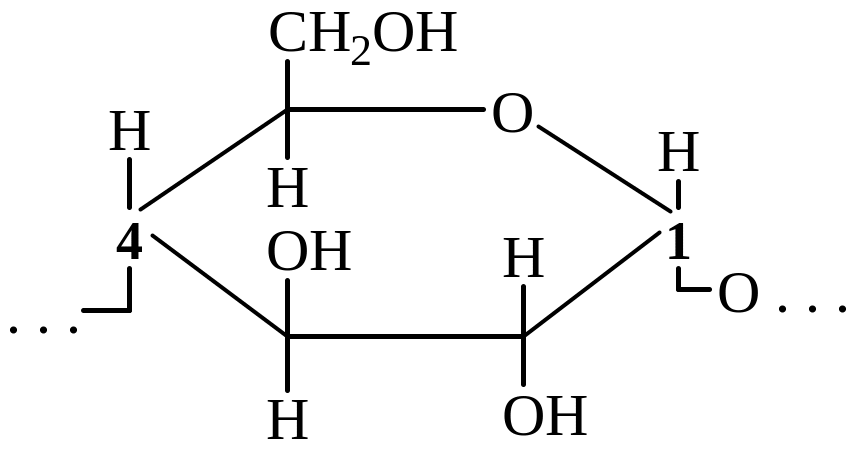
Амилопектин, в отличие от амилозы, не растворим в воде и имеет разветвленное строение. В его молекуле остатки α – D – глюкозы связаны не только 1,4 – связями, но и 1,6 – связями.
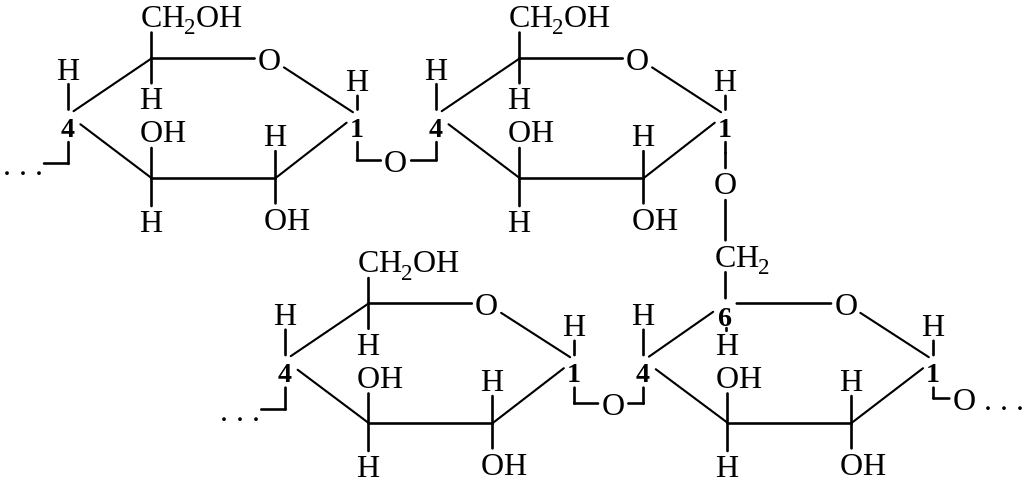
При нагревании в кислой среде крахмал гидролизуется с разрывом связей между остатками α – D – глюкозы. При этом образуется ряд промежуточных продуктов, конечным продуктом гидролиза является α – D – глюкопираноза.
Целлюлоза (клетчатка) – основное вещество растительных клеток. Древесина на 50% состоит из целлюлозы, а хлопок и лён – это практически чистая целлюлоза.
Целлюлоза представляет собой твердое волокнистое вещество, нерастворимое в воде, но растворимое в аммиачном растворе гидроксида меди (II) (реактив Швейцера).
Целлюлоза в отличие от крахмала состоит только из линейных цепей, содержащих остатки β – D – глюкопиранозы, которые связаны через первый и четвертый углеродные атомы. Элементарное звено полимера целлюлозы выглядит следующим образом:
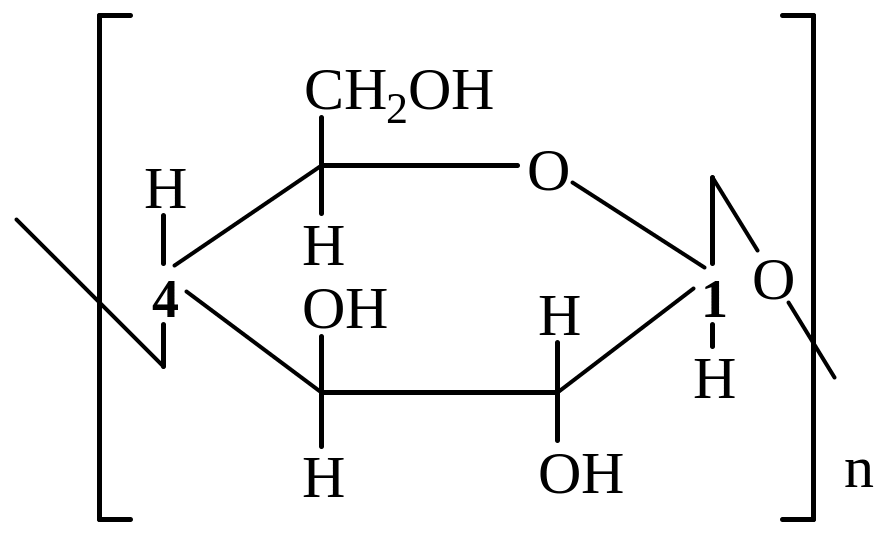
Химические свойства.
Гидролиз целлюлозы происходит при нагревании в кислой среде. Конечным продуктом гидролиза является β – D – глюкопираноза.
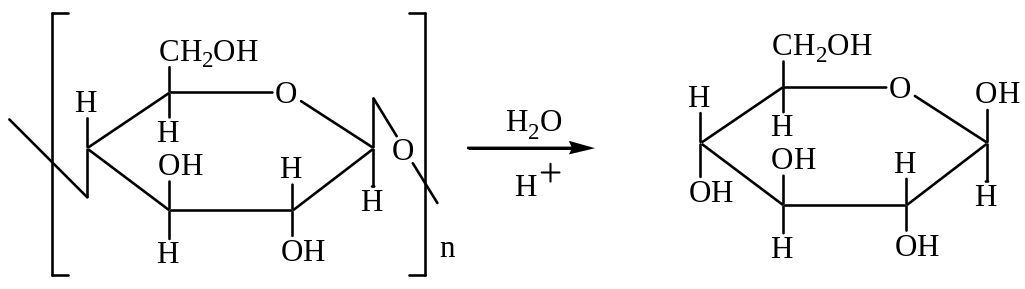
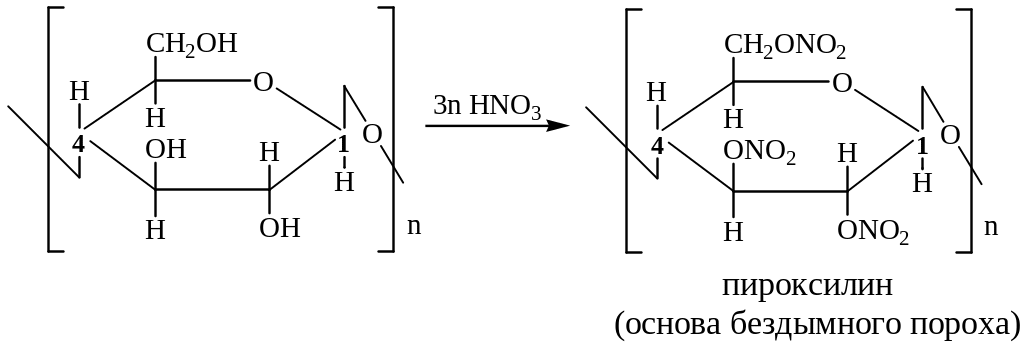
Для целлюлозы характерно образование сложных эфиров за счет трёх гидроксильных групп, содержащихся в каждом звене полимера:
Образование тринитроцеллюлозы:
Образование триацетата целлюлозы:
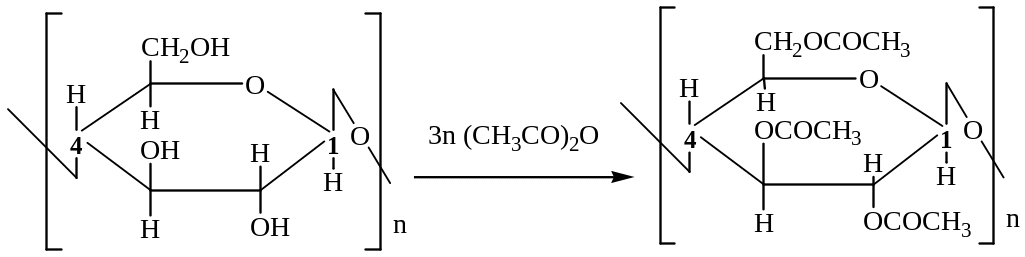
Триацетат целлюлозы – основа производства ацетатной кинопленки, лаков, промежуточный продукт в производстве ацетатного волокна. Ацетат целлюлозы получают методом частичного гидролиза триацетата целлюлозы.
Из целлюлозы получают вискозу – искусственное волокно:

При растворении ксантогената целлюлозы в разбавленных растворах щелочи образуется вязкая масса (вискоза), которую затем продавливают через фильеры в ванну с подкисленной водой, так получают тонкие шелковистые нити, по своему химическому строению полностью соответствующие строению целлюлозы. Полученное волокно часто называют восстановленной целлюлозой:
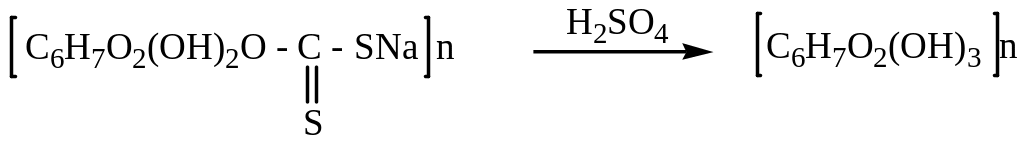
9. Арены. Ароматические углеводороды и их производные.
9.1. Бензол и его производные. Строение, изомерия.
Впервые структурную формулу бензола, открытого в 1825 году, наиболее удачно описывающую уже известные свойства бензола, предложил Кекуле в 1865 году.
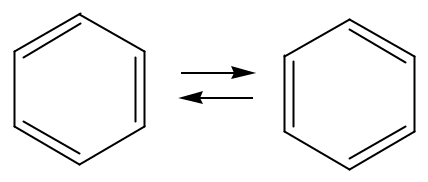
Кекуле считал, что происходит постоянный переход связи между атомами углерода в бензоле из простой в двойную, что и объясняет инертность бензола в реакциях присоединения и окисления несмотря на его высокую формальную ненасыщенность С6Н6, т. е. СnHn!
Современная теоретическая химия объясняет строение бензола следующим образом.
Ш есть
атомов углерода, находящихся в
sp2-гибридизации
связаны за счет гибридных sp2-орбиталей
между собой, образуя правильный плоский
шестиугольник.
есть
атомов углерода, находящихся в
sp2-гибридизации
связаны за счет гибридных sp2-орбиталей
между собой, образуя правильный плоский
шестиугольник.
Каждый атом углерода связан также с одним атомом водорода. Углы между σ-связями – 120о.
Негибридизованные р-орбитали каждого атома углерода взаимно перекрываются над и под плоскостью кольца, образуя единую шестиэлектронную, сопряженную систему.
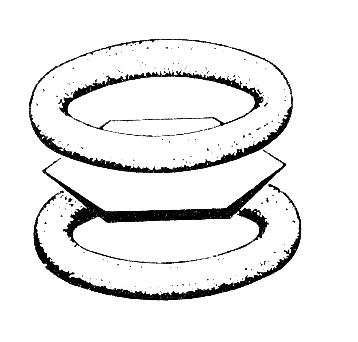
Результатом такого электронного строения является снижение энергии соединения и как следствие – высокая термодинамическая устойчивость, а также устойчивость к действию окислителей при формальной ненасыщенности.
В соответствии с правилом Хюккеля к ароматическим соединениям относятся соединения, имеющие плоское циклическое строение и замкнутую систему сопряжения, число электронов в которой равно 4n+2, где n – натуральный ряд чисел.
В настоящее время графически изображают формулу бензола либо по Кекуле, либо в виде шестиугольника с вписанной окружностью, символизирующей делокализацию электронов.
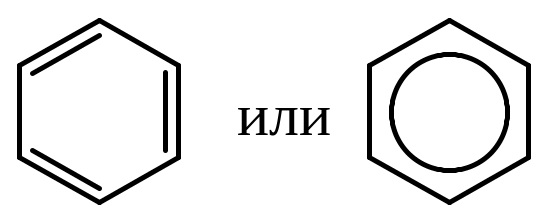
Атомы водорода в бензоле могут быть замещены на алкильные, алкенильные, алкинильные и т. д. радикалы, а также атомы других элементов и функциональные группы.
Ниже приведены примеры таких соединений, а также названия (номенклатура) этих соединений.
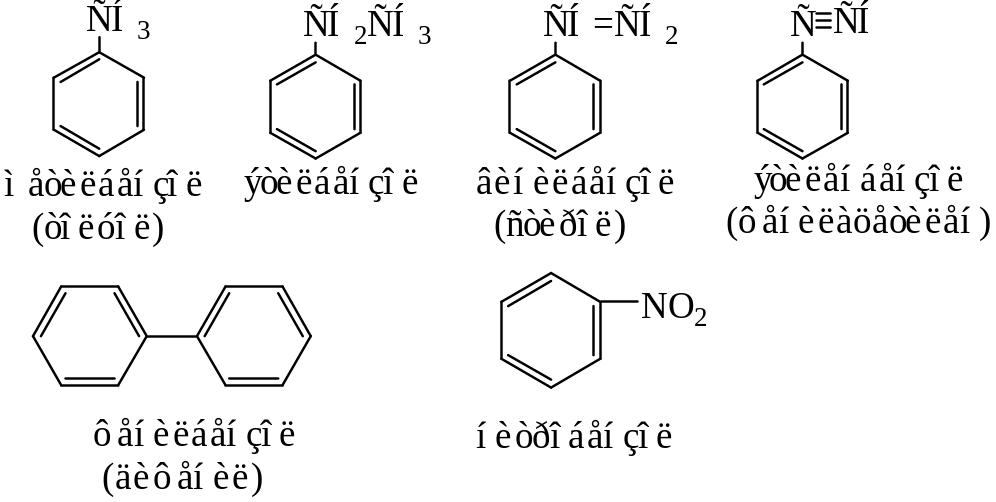
Радикал, образованный в результате отрыва одного атома водорода от молекулы бензола, называется фенил.
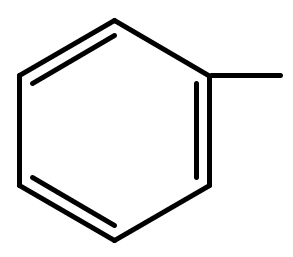
Монозамещенные производные бензола не имеют изомеров, т. к. все положения в незамещенном бензоле равноценны.
Гомологи бензола, имеющие два и более заместителей, имеют изомеры, связанные с взаимным положением заместителей.
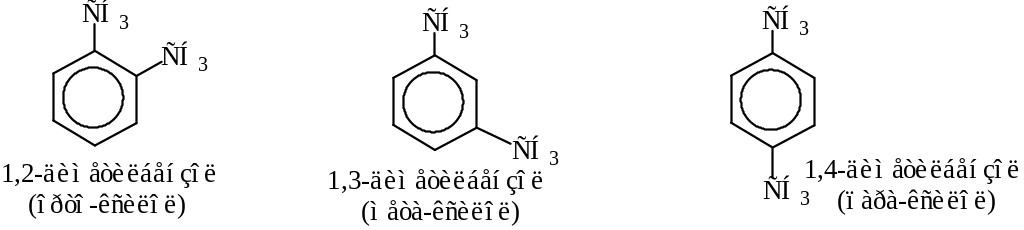
Верхние названия даны по номенклатуре ИЮПАК. Нижние названия даны по тривиальной номенклатуре.
Название относительного положения заместителей орто (рядом), мета (через один атом), пара (через два атома) сохранилось и широко используется до сих пор. Например,