- •Методическое пособие для студентов нехимических специальностей заочного отделения
- •Подготовлено к печати на кафедре органической химии
- •Редактор
- •1. Введение
- •Свойства ковалентной связи.
- •Понятие об индуктивном и мезомерном эффектах
- •Классификация органических реагентов и реакций.
- •2. Номенклатура органических соединений
- •3. Углеводороды
- •3.1. Алканы (предельные, насыщенные углеводороды)
- •3.1.1. Методы получения алканов.
- •3.1.2. Химические свойства алканов
- •Реакции замещения
- •3.2 Циклоалканы
- •Непредельные или ненасыщенные углеводороды
- •3.3 Алкены
- •3.3.1.Методы получения
- •3.3.2.Химические свойства алкенов
- •3.4. Алкадиены.
- •3.5. Алкины.
- •3.5.1.Химические свойства алкинов
- •Как и в случае алкенов реакция идет в присутствии катализаторов (Pt, Pd, Ni и др.) и может быть остановлена на стадии образования алкена.
- •3.6. Реакция полимеризации алкенов и алкадиенов (синтез высокомолекулярных соединений).
- •4. Функциональные производные углеводородов.
- •4.1. Галогенопроизводные.
- •4.1.1. Методы получения и химические свойства галогенопроизводных.
- •5. Кислородосодержащие соединения.
- •5.1. Алканолы (спирты).
- •5.1.1 . Получение спиртов.
- •5.1.2. Химические свойства спиртов.
- •Реакция со щелочными металлами
- •5.2. Альдегиды, кетоны, карбоновые кислоты.
- •5.2.1. Методы получения альдегидов, кетонов, карбоновых кислот.
- •5.2.2. Химические свойства альдегидов и кетонов.
- •5.2.3. Химические свойства карбоновых кислот
- •6. Азотосодержащие производные углеводородов
- •6.1. Алифатические нитросоединения.
- •6.2. Алифатические амины.
- •6.2.1. Химические свойства аминов
- •Основные свойства
- •6.3. Аминокислоты и их производные.
- •6.3.1. Полиамидные волокна.
- •7. Изомерия органических соединений
- •Структурная изомерия
- •Пространственная изомерия
- •8. Сахариды (углеводы)
- •8.1.Моносахариды
- •8.1.1 Строение, изомерия
- •8.1.2. Химические свойства моносахаридов
- •8.2. Полисахариды
- •9. Арены. Ароматические углеводороды и их производные.
- •9.1. Бензол и его производные. Строение, изомерия.
- •9.1.1. Методы получения углеводородов ряда бензола.
- •9.1.2. Химические свойства углеводородов ряда бензола.
- •Электрофильное замещение.
- •Влияние заместителей в бензольном ядре на реакцию электрофильного замещения.
- •9.3. Ароматические амины.
- •9.3.1. Химические свойства аминов
- •Реакции аминогруппы.
- •Реакции ароматического ядра.
- •9.4. Ароматические азо- и диазосоединения. Азокрасители.
- •9.4.1. Химические свойства солей диазония
- •Реакции с выделением азота.
- •Реакции без выделения азота.
- •Контрольная работа №1.
- •Вариант №1
- •Контрольная работа № 2.
- •Содержание
- •1. Введение…………………………………………….……………...3
6.3.1. Полиамидные волокна.
Близкими по строению к натуральным белковым волокнам являются синтетические волокна – полиамидные. Разработано несколько способов синтеза таких волокон, из которых отметим наиболее известные:
Полимеризацией капролактама получают волокно – капрон.
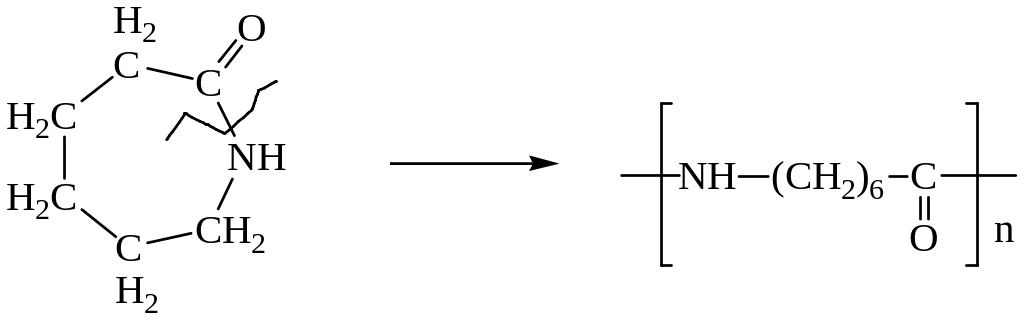
Поликонденсацией 1,6 –гександиамина и 1,6 – гександиовой (адипиновой) кислоты получают волокно нейлон.
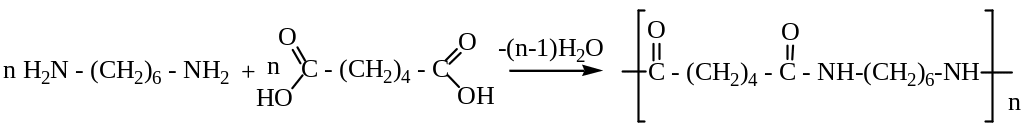
Нужно отметить, что при всей внешней схожести строения макромолекул шерсти, шелка и синтетических полиамидов указанные волокна очень отличаются по своим физико-химическим свойствам, что приводит и к разным свойствам получаемых из них текстильных материалов.
7. Изомерия органических соединений
.
Изомерия органических веществ – это один из ключевых вопросов органической химии, обуславливающих специфику и разнообразие свойств органических соединений.
Рассмотрение этого явления во всей его полноте не позволяет объём данного курса, поэтому мы ограничимся следующими его положениями.
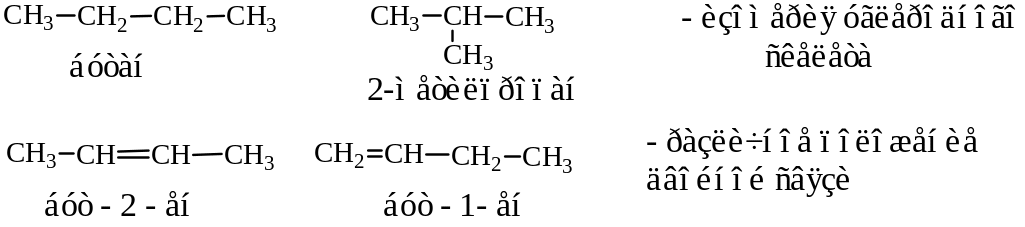
Структурная изомерия
Структурная изомерия – изомерия, связанная со строением углеродного скелета или с положением функциональных групп в молекуле.
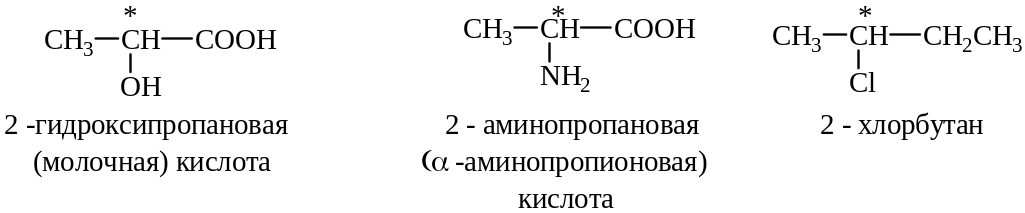
Пространственная изомерия
Пространственная изомерия включает геометрическую и оптическую изомерию.
Геометрическая изомерия связана со спецификой строения кратной связи.
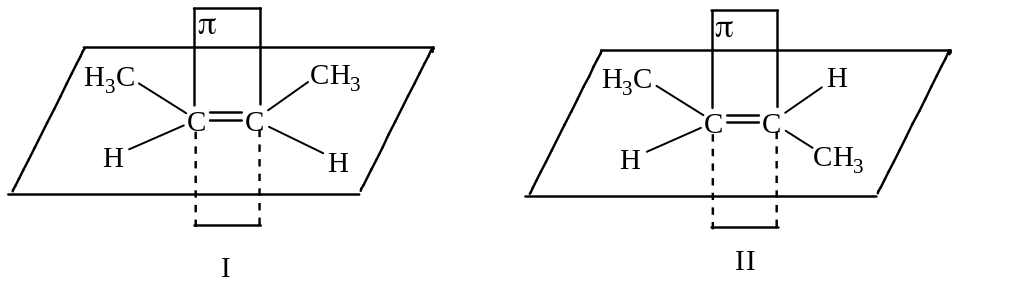
В силу специфики строения двойной углеродной связи свободный переход из формы I в форму II без разрыва связи невозможен (см.[1]гл.3).
Поэтому появляются два соединения, имеющих одинаковую структурную формулу, одинаковый состав, но разное (зафиксированное) положение групп в пространстве. Эти соединения обладают различными физико-химическими свойствами, в том числе и реакционной способностью и называются пространственными изомерами.
По традиционной номенклатуре их называют цис- или транс- изомерами.
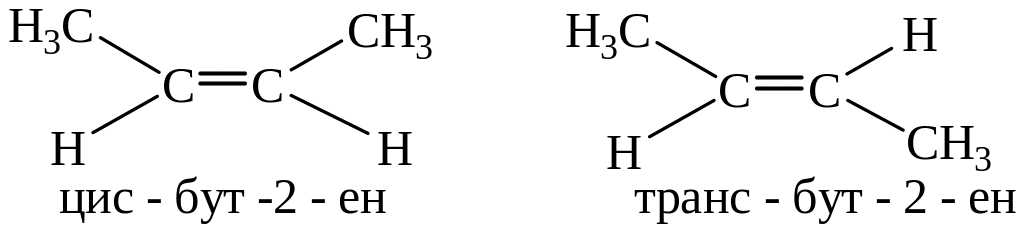
Условием такой изомерии является наличие двух различных заместителей у каждого атома углерода, связанного двойной связью.
По современной номенклатуре такие изомеры называют E, Z – изомерами.
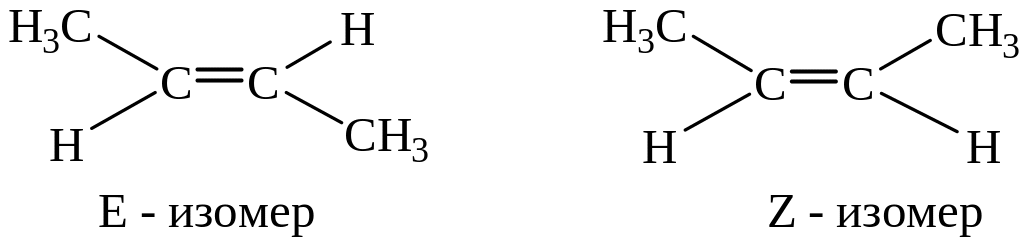
Е – от немецкого слова entgegen – напротив
Z – от немецкого слова zusammen – вместе,
что соответствует взаимному положению заместителей (в данном случае метильных групп CH3-) относительно двойной связи.
Оптическая изомерия (энантиомерия) связана с наличием асимметрического атома углерода.
В 1874 г. в работах Вант – Гоффа и Ле Беля нашло объяснение обнаруженное ранее явление, что некоторые органические вещества, имея одинаковый химический состав и химическое строение, а также физико – химические свойства отличаются только одним – одно из них вращает плоскость поляризованного света на определенный угол вправо, а другое на тот же угол, но влево (подробнее об этом явлении (см.[2], стр. 48).
Для того чтобы такое свойство проявлялось необходимо, чтобы в органической молекуле был асимметрический центр, например атом углерода, связанный четырьмя простыми связями с четырьмя различными заместителями. В этом случае появляется возможность существования двух зеркальных (оптических) изомеров, которые не могут быть совмещены друг с другом.
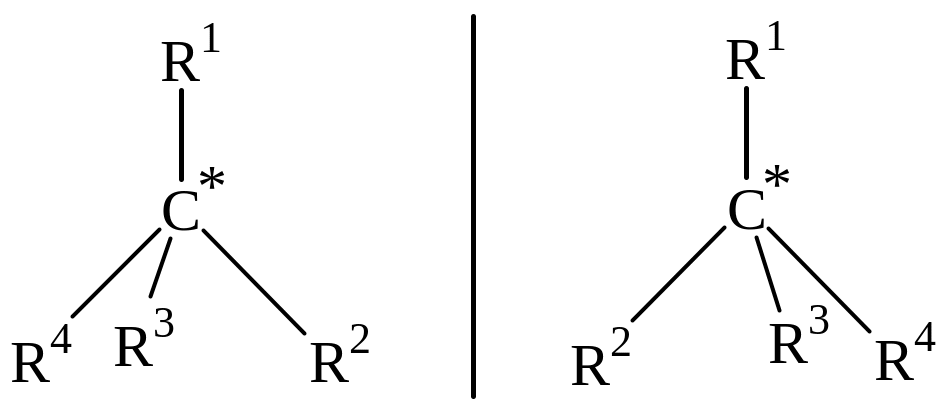
Асимметрический атом углерода называется “хиральный центр”.
Значение этого вида изомерии в органической химии огромно, т.к. биохимические процессы, идущие в живых организмах, определяются во многом пространственным строением молекул. Различие в свойствах таких основных природных полимеров, как целлюлоза и крахмал, также основано на различии в пространственном положении групп у одного из атомов углерода.
Приведем некоторые примеры оптически активных соединений.