
- •Рудненский индустриальный институт Кафедра безопасности жизнедеятельности и промышленной экологии
- •Рудный 2008
- •2 Cтроение атома
- •3 Периодическая система элементов д. И. Менделеева
- •3.1 Примеры решения задач
- •5 Энергетика химических процессов
- •6 Способы выражения концентрации раствора
- •300 Г раствора содержит 18 г кислоты
- •300 Г раствора содержит 18 г кислоты
- •7 Ионные реакции обмена
- •8 Гидролиз солей
- •9 Окислительно-восстановительные реакции
- •10 Электродные потенциалы и электродвижущие силы
- •Одобрено на заседании мк эмф
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РЕСПУБЛИКИ КАЗАХСТАН
Рудненский индустриальный институт Кафедра безопасности жизнедеятельности и промышленной экологии
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
к контрольной работе по дисциплине «Химия»
для студентов технических специальностей
Рудный 2008
ББК 20.1
Автор: Барулина И.В. Методические указания к контрольной работе по дисциплине «Химия» – Рудный, РИИ, 2008. – 55 с.
Рецензенты: Куликова Г.Г., заведующий кафедрой БЖиПЭ, к.х.н.
Олейник А.И., заведующий кафедрой Ст, д.т.н.
Рекомендовано к изданию УМС РИИ
В методических указаниях контрольной работе по дисциплине «Химия» содержатся общие методические указания к выполнению и оформлению контрольной работы, примеры решения задач, задания для самостоятельного решения, рекомендуемая литература.
Методические указания предназначены для студентов заочного отделения технических специальностей.
Ил. 2, табл. 6, список лит. 7 назв.
для внутривузовского использования
© Рудненский индустриальный институт 2008
СОДЕРЖАНИЕ
|
Введение |
4 |
1 |
Эквиваленты простых и сложных веществ. Закон эквивалентов |
5 |
2 |
Строение атома |
8 |
3 |
Периодическая система элементов Д. И. Менделеева |
14 |
4 |
Химическая связь и строение молекул. Конденсированное состояние вещества |
17 |
5 |
Энергетика химических процессов |
21 |
6 |
Способы выражения концентрации раствора |
27 |
7 |
Ионные реакции обмена |
30 |
8 |
Гидролиз солей |
32 |
9 |
Окислительно-восстановительные реакции |
35 |
10 |
Электродные потенциалы и электродвижущие силы |
39 |
11 |
Электролиз |
43 |
12 |
Коррозия металлов |
46 |
|
Список литературы |
49 |
|
Приложение А - Образец оформления титульного листа |
50 |
|
Приложение Б - Образец оформления списка литературы |
51 |
|
Приложение В - Таблица вариантов контрольной работы |
52 |
ВВЕДЕНИЕ
Основной вид учебных занятий студентов заочного факультета – самостоятельная работа над учебным материалом. По дисциплине «Химия» она слагается из следующих элементов: изучение материала по учебникам и учебным пособиям; выполнение контрольных заданий; выполнение лабораторного практикума; индивидуальные консультации; посещение лекций; сдача экзамена по дисциплине.
Изучение каждого раздела рекомендуется проводить, придерживаясь следующего порядка: 1) познакомиться по программе с содержанием раздела, соответствующего заданию, уяснить объем и последовательность излагаемых вопросов; 2) приступить к выполнению задания только после основательного изучения раздела; 3) прочитать в учебнике весь относящийся к данному разделу материал, обратив внимание на физическую сущность явления, теоретические положения, математические зависимости и графический материал; 4) приступить к ответу на вопросы контрольного задания и к решению задач, используя примеры, приведенные в разделе решения типовых задач.
При возникновении трудностей при решении задач необходимо обратиться к преподавателю за консультацией.
Отвечать на вопросы и решать задачи необходимо в той последовательности, в какой они даны в методических указаниях.
Решение задач и ответы на теоретические вопросы должны быть обоснованы. При решении задач нужно приводить весь ход решения и математические преобразования.
Контрольная работа должна быть аккуратно оформлена. На обложке двенадцати листовой тетради должны быть указаны: название дисциплины, по которой выполнена работа, номер группы, фамилия, имя, отчество студента, шифр и номер варианта, а также фамилия и инициалы преподавателя, рецензирующего работу (приложение А). Для замечаний рецензента надо оставлять широкие поля; писать четко и ясно; номера и условия задач переписывать в том порядке, в каком они указаны в задании. В конце работы должен быть список использованной литературы, оформленный по существующим правилам (приложение Б).
Если контрольная работа не зачтена, нужно выполнить работу над ошибками в соответствии с указаниями рецензента. Исправления следует выполнять в конце тетради, а не в рецензированном тексте. Контрольная работа, выполненная не по своему варианту, не рецензируется и не зачитывается.
Выбор варианта каждого номера задачи проводится по двум последним цифрам шифра, написанного в зачетной книжке (приложение В).
1 ЭКВИВАЛЕНТЫ ПРОСТЫХ И СЛОЖНЫХ ВЕЩЕСТВ. ЗАКОН ЭКВИВАЛЕНТОВ
1.1 Примеры решения задач
Пример 1. На восстановление 7,09 г оксида двухвалентного металла требуется 2,24 л водорода, измеренного при н. у. Вычислить молярные массы эквивалентов оксида и металла. Чему равна атомная масса металла?
Решение.
По закону эквивалентов массы веществ
m1
и m2,
вступающих в реакцию, пропорциональны
молярным массам эквивалентов М![]() и М
:
и М
:
![]() , (1)
, (1)
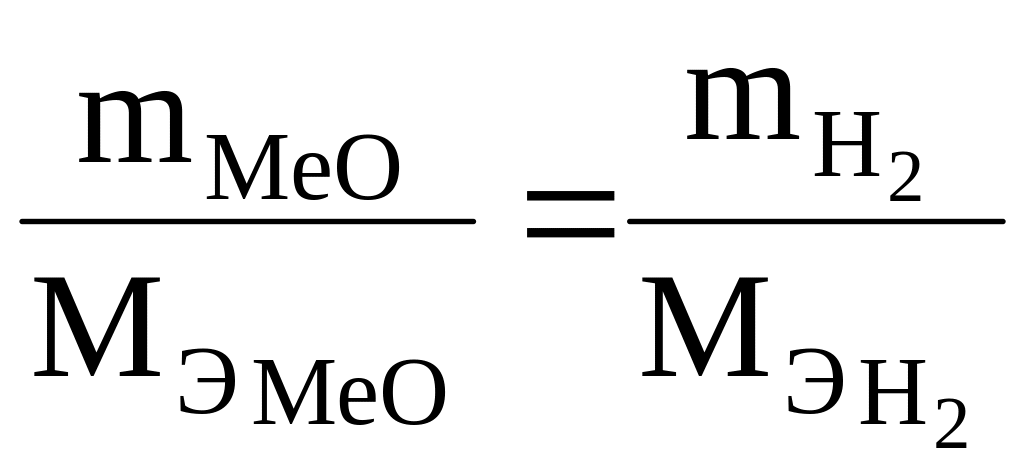 .
(2)
.
(2)
Если
одно из веществ находится в газообразном
состоянии, то, как правило, его количество
измеряется в объемных единицах (см3,
л, м3).
В
уравнении (2) отношение
![]()
![]() заменяем
равным ему отношением
заменяем
равным ему отношением
![]() ,
где
,
где
![]()
![]() –
объем водорода,
–
объем водорода,
![]() -
объем
эквивалента водорода.
-
объем
эквивалента водорода.
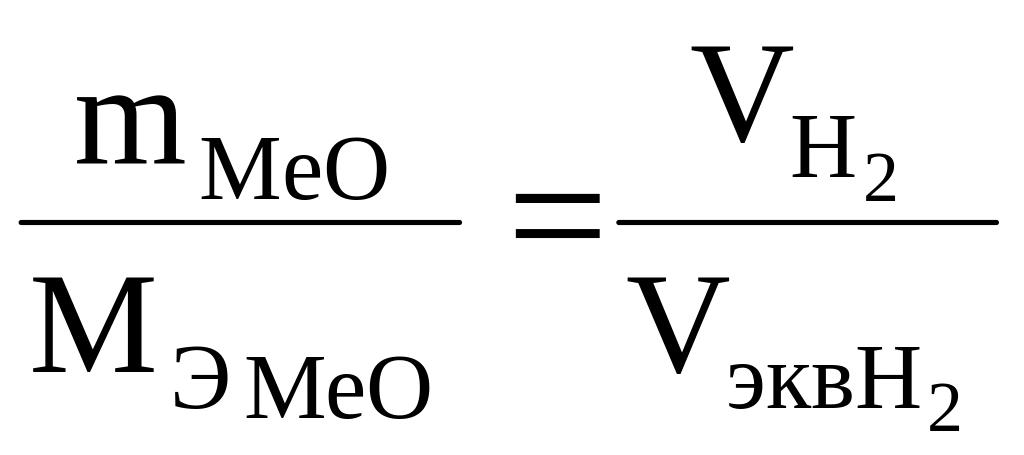 (3)
(3)
Молярная масса эквивалентов водорода (1,008 г.) равна половине его молярной массы (2,016 г), поэтому согласно следствию закона Авогадро (при н.у.)
![]()
Из соотношения (3) находим молярную массу эквивалента оксида металла (МеО):
![]() , (4)
, (4)
![]() . (5)
. (5)
По
закону эквивалентов
![]() =
=![]() ,
отсюда
,
отсюда
=
![]() =
35,45 - 8 = 27,45 (г/моль-экв.).
=
35,45 - 8 = 27,45 (г/моль-экв.).
Атомную массу металла определяем из соотношения МЭ = А/В, где МЭ — молярная масса эквивалентов, А — атомная масса, В — валентность элемента. А = МЭ · В = 27,45 ·2 = 54,9.
Пример 2. Сколько металла, атомная масса эквивалента которого равна 12,16, взаимодействует с 310 см3 кислорода, измеренного при н.у.?
Решение. Один моль О2 (32 г) при н. у. занимает объем 22,4 л, а объем эквивалента кислорода (8 г) 22,4/4 = 5,6 л. По закону эквивалентов:
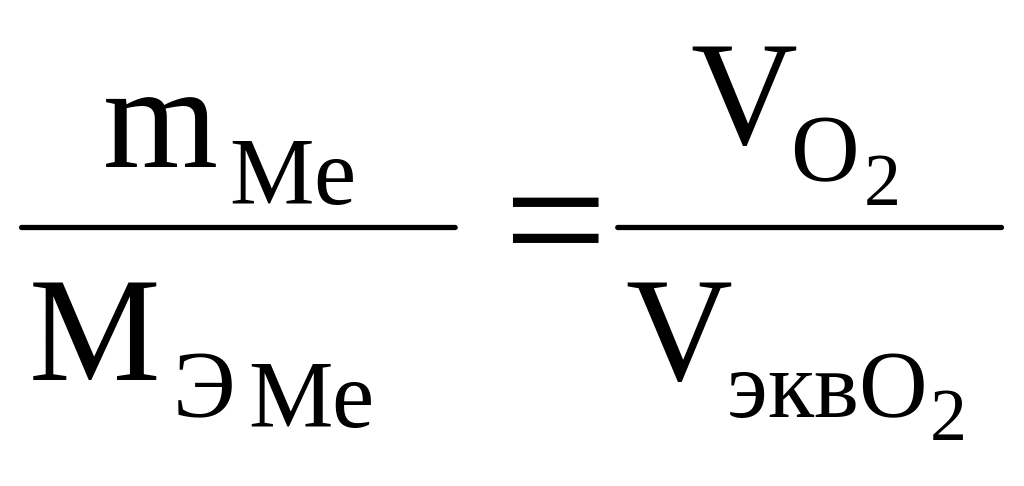 , (6)
, (6)
или
![]() , (7)
, (7)
откуда
![]() . (8)
. (8)
Пример 3. Вычислить молярные массы эквивалентов H2SO4 и Al(OH)3, в реакциях, выраженных уравнениями:
H2SО4 + КОН = KHSО4 + H2O, (9)
H2SO4 + Mg = MgSО4 + Н2 , (10)
Al(OH)3 + HCl = A1(OH)2C1 + H2O , (11)
Al(OH)3 + 3HNO3 =- Al(NO3)3 + 3H2O . (12)
Решение:
Молярная масса эквивалентов сложного
вещества, так же как и молярная масса
эквивалентов элемента, может иметь
различные значения и зависит от того,
в какую реакцию обмена вступает это
вещество. Молярная масса эквивалентов
кислоты (основания) равна молярной массе
(М), деленной на число атомов водорода,
замещенных в данной реакции на металл
(на число вступающих в реакцию гидроксильных
групп). Следовательно, молярная масса
эквивалентов H2SO4
в реакции (9) равна
![]() ,
а в реакции (10) —
/2.
молярная масса эквивалентов А1(ОН)3
в
реакции (11) равна
,
а в реакции (10) —
/2.
молярная масса эквивалентов А1(ОН)3
в
реакции (11) равна
![]() ,
а в реакции (12) —
/3.
,
а в реакции (12) —
/3.
Задачу можно решить и другим способом. Так как H2SO4 взаимодействует с одним эквивалентом КОН и двумя эквивалентами магния, то ее молярная масса эквивалентов равна в реакции (9) М/1 и в реакции (10) М/2. Аl(ОН)3 взаимодействует с одним эквивалентом НСl и тремя эквивалентами HNO3, поэтому его молярная масса эквивалентов в реакции (11) равна М/1, в реакции (12) M/3.
Пример
4. Из 3,85 г нитрата металла получено 1,60 г
его гидроксида. Вычислить молярную
массу эквивалентов металла (М![]() )
)
Решение. При решении задачи следует иметь в виду: а) молярная масса эквивалентов гидроксида равна сумме молярных масс эквивалентов металла и гидроксильной группы; б) молярная масса эквивалентов соли равна сумме молярных масс эквивалентов металла и кислотного остатка. Учитывая сказанное, подставляем соответствующие данные в соотношение (1):
![]() =
=
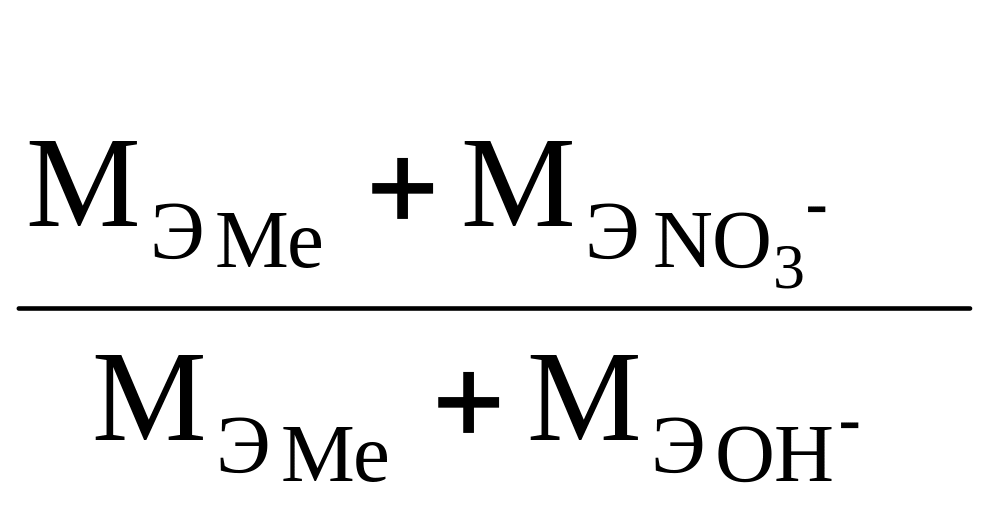 ,
(13)
,
(13)
=
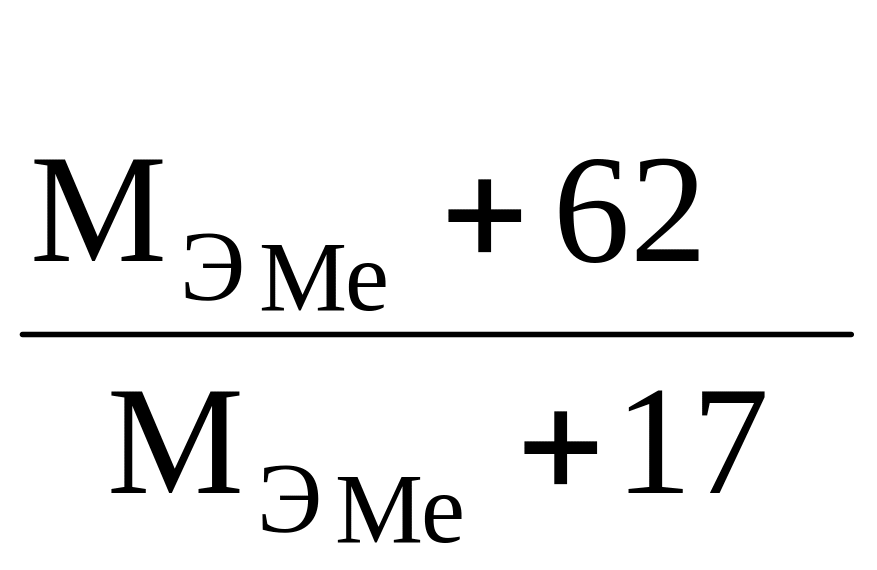 .
(14)
.
(14)
Решая уравнение (14), получаем М = 15.
1.2 Задания для самостоятельного решения
1. При восстановлении водородом 10,17 г оксида двухвалентного металла образовалось 2,25 г воды, молярная масса эквивалентов которой равна 9 г/моль. Вычислите молярную массу эквивалентов оксида и металла. Чему равна атомная масса металла?
2. Молярная масса эквивалентов трехвалентного металла равна 9 г/моль. Вычислите атомную массу металла, молярную массу эквивалентов его оксида и массовую долю кислорода в оксиде.
3. Из 1,35 г оксида металла получается 3,15 г его нитрата. Вычислите молярную массу эквивалентов металла.
4. Из 1,3 г гидроксида металла получается 2,85 г сульфата этого же металла. Вычислите молярную массу эквивалентов металла.
5. Оксид трехвалентного элемента содержит 31,58% кислорода. Вычислите молярную массу эквивалентов и атомную массу этого элемента.
6. Один оксид марганца содержит 22,56% кислорода, а другой — 50,50%. Вычислите молярные массы эквивалентов марганца и этих оксидах и составьте их формулы.
7. При сгорании серы в кислороде образовалось 12,8 г SO2. Сколько г кислорода требуется на эту реакцию? Чему равны молярные массы эквивалентов серы и ее оксида?
8. Вычислите молярные массы эквивалентов Н3РО4 в реакциях образования: а) гидрофосфата; б) дигидрофосфата; в) ортофосфата.
9. В 2,48 г оксида одновалентного металла содержится 1,84 г металла. Вычислите молярные массы эквивалентов металла и его оксида.
10. Чему равна молярная масса эквивалентов воды при взаимодействии ее: а) с натрием; б) с оксидом натрия. Ответ: 18; 9.
11. При восстановлении 1,2 г оксида металла водородом образовалось 0,27 г воды. Вычислите молярные массы эквивалентов оксида металла и металла.
12. Напишите уравнения реакций Fe(OH)3 с соляной кислотой, при которых образуются следующие соединения железа: а) дигидроксохлорид; б) гидроксодихлорид; в) трихлорид. Вычислите молярную массу эквивалентов Fe(ОН)3 в каждой из этих реакций.
13. Избытком едкого кали подействовали на растворы: а) дигидрофосфата калия; б) дигидроксонитрата висмута (+3). Напишите уравнения реакций этих веществ с КОН и определите их молярные массы эквивалентов.
14. Вещество содержит 39,0% серы, молярная масса эквивалентов которой 16,0, и мышьяк. Вычислите молярную массу эквивалентов и валентность мышьяка, составьте формулу этого вещества.
15. Избытком соляной кислоты подействовали на растворы: а) гидрокарбоната кальция; б) гидроксодихлорида алюминия. Напишите уравнения реакций этих веществ с НС1 и определите их молярные массы эквивалентов.
16. При окислении 16,74 г двухвалентного металла образовалось 21,54 г оксида. Вычислите молярные массы эквивалентов металла и его оксида. Чему равна атомная масса металла?
17. При взаимодействии 3,24 г трехвалентного металла с кислотой выделяется 4,03 л водорода, измеренного при н.у. Вычислите молярную массу эквивалентов металла и его атомную массу.
18. В оксидах азота на два атома приходится: а) пять; б.) четыре; в) один атом кислорода. Вычислите молярные массы эквивалентов азота в оксидах и молярные массы эквивалентов оксидов.
19. Одна и та же масса металла соединяется с 1,591 г галогена и с 70,2 см3 кислорода, измеренного при н. у. Вычислите молярную массу эквивалентов галогена.
20. На нейтрализацию 0,943 г фосфористой кислоты Н3РО3 израсходовано 1,291 г КОН. Вычислите молярную массу эквивалентов кислоты и ее основность.
