
- •Конспект лекції: Насичені вуглеводні (Алкани)
- •Будова молекул
- •Хімічні властивості
- •Добування
- •Застосування
- •Ненасичені вуглеводні
- •Характеристика деяких алкенів
- •Будова молекул
- •Фізичні властивості
- •Хімічні властивості
- •Реакції алкенів
- •Добування
- •Застосування
- •Будова молекули
- •Фізичні властивості
- •Хімічні властивості
- •Реакції алкінів
- •2.Часткове окиснення.
- •3. Заміщення.
- •4. Приєднання.
- •Добування. Методи добування ацетиленових вуглеводнів
Застосування
|
З етиленових вуглеводнів добувають багато різних продуктів, насамперед поліетилен і поліпропілен, які використовують для виробництва пластмас.
Алкіни
Вуглеводні з одним потрійним зв'язком у молекулі належать до ацетиленових вуглеводнів, за назвою найпростішого – ацетилену С2Н2:
![]()

Рис. Кулестержнева (а) та масштабна (б) моделі молекули ацетилену
Міжнародна назва ацетиленових вуглеводнів – алкіни.
Загальна формула алкенів СnН2n-2.
Таблиця. Характеристика деяких алкінів

Будова молекули
Згідно з гіпотезою гібридизації, в момент утворення молекули ацетилену s-електронна хмара атома Карбону гібридизується з однією p-електронною хмарою, в результаті чого утворюютья дві нові sp-гібридизовані електронні хмари (рис. 3.4.20.)
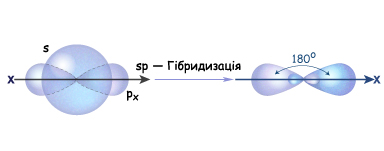
Рис. Схема утворення sp-гібридизованих електронних хмар атома Карбону
Гібридизовані електронні хмари двох атомів Карбону перекриваються між собою та з s-електронними хмарами атомів Гідрогену з утворенням s-зв'язків
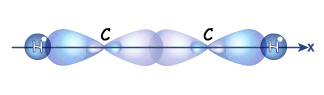
Схема утворення s-зв’язків у молекулі ацетилену.
Негібридизовані p-електронні хмари двох атомів Карбону, перекриваючись, утворюють два p-зв'язки. Оскільки p-електронні хмари мають форму об'ємних вісімок, то перекривання відбувається поза площиною s-зв'язку
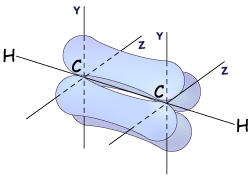
Рис. Схема утворення p-зв’язків у молекулі ацетилену
Отже, між атомами Карбону в молекулі етилену утворюється потрійний зв'язок : один s-, два -- p- зв'язки. Довжина потрійного зв'язку – 0,120 нм, валентні кути – 180о, енергія зв'язку – 839 кДж/моль
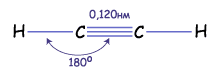
Рис. Геометрія молекули ацетилену
Алкінам властива структурна ізомерія карбонового скелета і положення кратного зв'язку. Наприклад, для сполуки складу С5Н8 можливі такі ізомери:
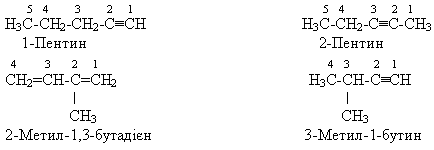
Фізичні властивості
Температури плавлення і кипіння алкінів закономірно змінюються зі зростанням числа атомів Карбону в молекулах.
Ацетилен – безбарвний газ, без запаху, мало розчинний у воді, трохи легший за повітря.
У природі ацетиленові вуглеводні не трапляються через високу хімічну активність цих сполук.
Хімічні властивості
Хімічна активність алкінів зумовлена наявністю в молекулах потрійного зв'язку.
Реакції алкінів
1. Горіння. Ацетиленові вуглеводні згоряють з утворенням вуглекислого газу і води. Порівняно з метаном і етиленом ацетилен горить ще більш світним полум'ям, оскільки масова частка Карбону в його молекулі становить 92%.
2.Часткове окиснення.
Ацетиленові вуглеводні, подібно до етиленових, легко окиснюються розчином калій перманганату, при цьому утворюються оксигеновмісні сполуки.
3. Заміщення.
Зв'язок С—Н у молекулах алкінів з кінцевим потрійним зв'язком значною мірою поляризований і може розриватись, за цим зв'язком можуть відбуватись реакції заміщення. Атом Гідрогену здатний заміщуватися, наприклад, на атом металу. Кальцій карбід СаС2 належить до ацетиленідів. Ацетиленіди купруму(І) і аргентуму(І) вибухають від удару чи нагрівання.
4. Приєднання.
За місцем кратного зв'язку алкени вступають у реакцію приєднання з воднем. У результаті повного гідрування утворюються алкани, а проміжними
продуктами є алкени. Наприклад, з ацетилену можна таким шляхом добути етилен, а далі – етан.
У результаті приєднання до молекули алкіну однієї молекули хлору чи брому утворюються дигалогенопохідні алкенів, а якщо в реакцію вступають ще дві молекули галогену – тетрагалогенопохідні алканів.
Галогенопохідні сполуки утворюються в результаті приєднання гідрогенгалогенідів. Приєднання останніх до несиметричних алкінів відбувається згідно з правилом Марковникова:
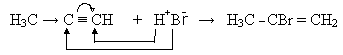
Молекули алкінів здатні сполучатись між собою з утворенням сполук різної будови. З двох молекул ацетилену утворюється важлива сполука вінілацетилен
![]()

