
- •Конспект лекції: Насичені вуглеводні (Алкани)
- •Будова молекул
- •Хімічні властивості
- •Добування
- •Застосування
- •Ненасичені вуглеводні
- •Характеристика деяких алкенів
- •Будова молекул
- •Фізичні властивості
- •Хімічні властивості
- •Реакції алкенів
- •Добування
- •Застосування
- •Будова молекули
- •Фізичні властивості
- •Хімічні властивості
- •Реакції алкінів
- •2.Часткове окиснення.
- •3. Заміщення.
- •4. Приєднання.
- •Добування. Методи добування ацетиленових вуглеводнів
Ненасичені вуглеводні
1. Алкени
2. Алкіни
Алкени
Ненасичені вуглеводні – ті, в яких атоми Карбону сполучені між собою за допомогою кратних (подвійних або потрійних) зв'язків. Вуглеводні з одним подвійним зв'язком у молекулі належать до етиленових вуглеводнів, за назвою найпростішого – етилену С2Н4 (рис. 3.4.13):

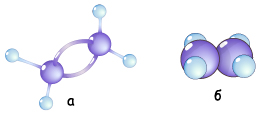
Рис. Кулестержнева (а) та масштабна (б) моделі молекули етилену
Міжнародна назва етиленових вуглеводнів – алкени.
Загальна формула алкенів СnН2n.
Характеристика деяких алкенів

Будова молекул
Згідно з гіпотезою гібридизації, в момент утворення молекули етилену s-електронна хмара атома Карбону гібридизується з двома p-електронними хмарами, в результаті чого утворюються три нові sp2-гібридизовані електронні хмари
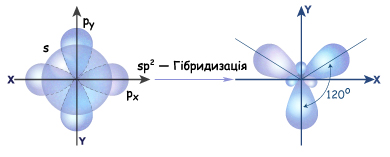
Рис. Схема утворення sp2-гібридизованих електронних хмар атома Карбону
Гібридизовані електронні хмари двох атомів Карбону, перекриваючись, утворюють s-зв'язок

Рис. Схема утворення s-зв’язків у молекулі етилену
Негібридизовані p-електронні хмари двох атомів Карбону, перекриваючись, утворюють так званий p-зв'язок. Оскільки p-електронні хмари мають форму об'ємних вісімок, то перекривання відбувається над і під площиною s-зв'язку
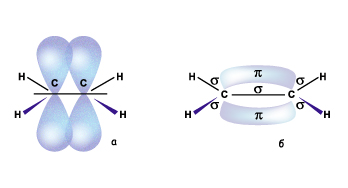
Рис. Перекривання р-електронів (а) і p-електронна хмара (б) в молекулі етилену
Отже, між атомами Карбону в молекулі етилену утворюється подвійний з'язок : один s-, другий -- p-зв'язок. Довжина подвійного зв'язку – 0,134 нм, валентні кути – 120о, енергія зв'язку – 614 кДж/моль
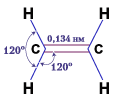
Рис. Геометрія молекули етилену
p-Зв'язок менш міцний, оскільки його електронна густина зосереджена не між атомними ядрами, а вище і нижче від них. Просторово p-зв'язок доступніший для реагентів порівняно з s-зв'язком, він легко поляризується і розривається.
Етиленовим вуглеводням властива структурна ізомерія карбонового скелета і положення кратного зв'язку:
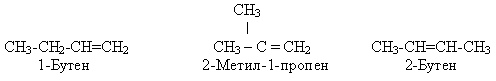
Для етиленових вуглеводнів характерна також просторова цис-, транс- ізомерія, коли два вуглеводневих радикали розміщуються з одного (цис-ізомер) або з різних (транс-ізомер) боків від подвійного зв'язку

Рис. Моделі просторових ізомерів 2-бутену:
а - цис-ізомер; б - транс-ізомер
Оскільки електронна густина p-зв'язку зосереджена над і під площиною молекули, то обертання атомів навколо подвійного зв'язку призводить до його розриву, при цьому утворюється нова сполука. Це підтверджують константи, наведені на рис. 3.4.18.
Цис-, транс- ізомерія – один із видів просторової ізомерії, оскільки зумовлена взаємним просторовим розміщенням атомів у молекулі.
Фізичні властивості
Алкени легші за воду й не розчинні у воді, але розчиняються в неполярних органічних розчинниках. Так само, як у алканів, їхні температури плавлення і кипіння підвищуються зі збільшенням довжини карбонового ланцюга. Алкени з розгалуженою будовою молекул мають нижчі температури плавлення порівняно зі сполуками з нормальною будовою молекул.
Хімічні властивості
Хімічна активність алкенів зумовлена наявністю в молекулах подвійного зв'язку.
