
- •Конспект лекції: Насичені вуглеводні (Алкани)
- •Будова молекул
- •Хімічні властивості
- •Добування
- •Застосування
- •Ненасичені вуглеводні
- •Характеристика деяких алкенів
- •Будова молекул
- •Фізичні властивості
- •Хімічні властивості
- •Реакції алкенів
- •Добування
- •Застосування
- •Будова молекули
- •Фізичні властивості
- •Хімічні властивості
- •Реакції алкінів
- •2.Часткове окиснення.
- •3. Заміщення.
- •4. Приєднання.
- •Добування. Методи добування ацетиленових вуглеводнів
Конспект лекції: Насичені вуглеводні (Алкани)

Вуглеводні – сполуки, до складу яких входять атоми Карбону й Гідрогену (від раніше вживаних назв елементів – вуглець і водень).
Насичені вуглеводні – ті, в яких валентності атомів Карбону повністю насичені атомами Гідрогену. Міжнародна назва насичених вуглеводнів – алкани, їх називають також парафіни.
Загальна
формула алканів
![]()

Наведені
в таблиці сполуки належать до гомологічного
ряду метану. Сполуки, що мають подібну
будову молекул
і подібні хімічні властивості й різняться
між собою за складом на одну чи кілька
груп
![]() ,
називають гомологами,
а ряд сполук – гомологічним рядом. Група
,
називають гомологами,
а ряд сполук – гомологічним рядом. Група
![]() –
гомологічна
різниця
ряду.
–
гомологічна
різниця
ряду.
Будова молекул
Молекула метану
має форму правильної тригональної
піраміди (тетраедра). Якщо атом Карбону
вписати в центр цієї геометричної
фігури, то чотири валентні зв'язки
спрямуються під кутом 109,5![]() до вершин, де розміщені атоми Гідрогену
( рис. 3.4.1).
до вершин, де розміщені атоми Гідрогену
( рис. 3.4.1).

Рис. Тетраедрична будова молекули метану.
Така будова молекули метану зумовлена електронною будовою атома Карбону.
У збудженому стані атом Карбону має чотири неспарені валентні електрони (рис. 3.4.2)

Електронна конфігурація атома Карбону
У момент
утворення молекули метану електроні
хмари одного s-
і трьох
p-електронів
гібридизуються (змішуються) і в результаті
утворюються чотири нові рівноцінні
гібридизовані електронні хмари, що
мають форму несиметричних вісімок,
витягнутих у напрямку від центра до
вершини тетраедра під кутом одна до
одної 109,5
.
Такий вид гібридизації називають
sp![]() -гібридизацією
-гібридизацією
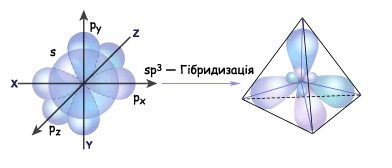
Рис. Схема утворення sp -гібридизованих електронних хмар атома Карбону
Чотири гібридизовані електронні хмари атома Карбону перекриваються з s-електронними хмарами атомів Гідрогену й утворюють чотири s-зв’язки

Рис. Схема утворення s-зв’язків у молекулі метану
Довжина зв’язків С—С становить 0,154 нм
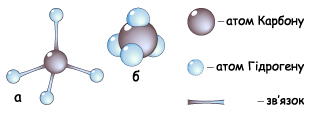
Рис. Кулестержнева (а) та масштабна (б) моделі молекули метану
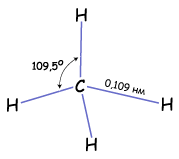
Рис. Геометрія молекули метану
У молекулах інших алканів валентні електрони атомів Карбону також перебувають у стані sp -гібридизації та утворюють s-зв’язки між собою і з атомами Гідрогену
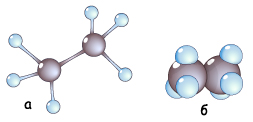
Рис. Кулестержнева (а) та масштабна (б) моделі молекули етану
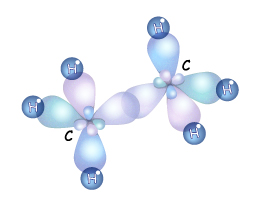
Рис. Схема утворення s-зв’язків у молекулі етану
Довжина зв’язків С—Н становить 0,154 нм

Рис.Геометрія молекули етану
Завдяки тетраедричній будові атомів Карбону молекули алканів мають форму зигзагоподібного ланцюга
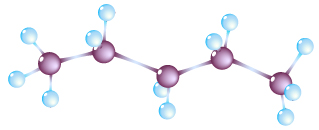
Рис. Зигзагоподібна модель молекули пентану
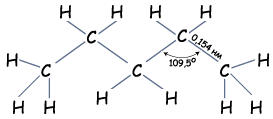
Рис. Геометрія молекули пентану
Алканам властива структурна ізомерія карбонового скелета
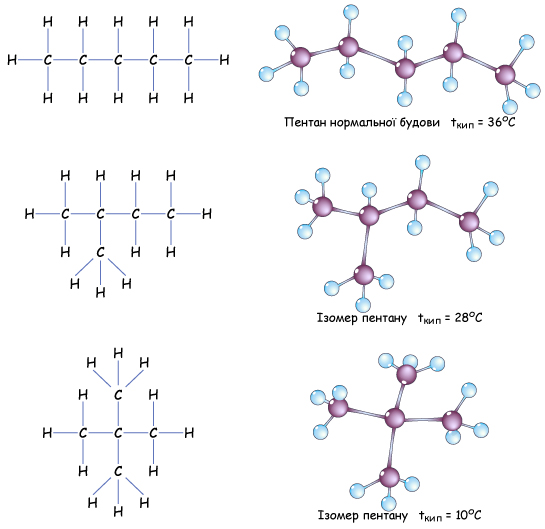
Рис. Структурні формули та моделі молекул ізомерів пентану
Фізичні властивості. Поширення у природі
Основні природні джерела алканів – нафта і природний газ. В останньому вміст метану становить близько 98%, решта – етан, пропан, бутан та інші вуглеводні. Для добування алканів нафту піддають переробці.
Метан утворився в надрах Землі, ймовірно, внаслідок взаємодії розпечених карбідів металів з водяною парою. На болотах метан виділяється у вигляді бульбашок на поверхні води (болотний газ). Газ утворюється в результаті гниття рослинних решток без доступу повітря.
Метан виявлено в атмосфері планет Юпітер і Сатурн.
Зі збільшенням
числа атомів Карбону в молекулі зростають
температури плавлення і кипіння алканів.
Перші чотири речовини за стандартних
умов – гази, далі йдуть рідини, а починаючи
з вуглеводню складу
![]() ,
- тверді речовини
,
- тверді речовини
Насичені вуглеводні нормальної (нерозгалуженої) будови мають вищі температури плавлення і кипіння порівняно з ізомерами.
Густина насичених вуглеводнів збільшується зі збільшенням розмірів молекул, проте всі вони легші за воду.
Пропан і бутан легко скраплюються за підвищеного тиску.
Алкани – неполярні або слабкополярні сполуки, практично не розчинні у воді.
Газуваті й тверді алкани не мають запаху, рідкі – мають характерний "бензеновий" запах.
