
- •Оглавление
- •Предисловие
- •Часть 1. Топливо и его сжигание
- •Раздел 1. Технические характеристики топлива
- •1.1 Топливо и его составные части
- •1.2 Теплота сгорания топлива.
- •Теплота сгорания твердого и жидкого топлива.
- •1.3 Условное топливо
- •1.4 Основы стехиометрического расчета горения топлива
- •Законы, лежащие в основе стехиометрических расчетов горения
- •1.4.2 Аналитический способ стехиометрических расчетов
- •Расход воздуха и выход продуктов полного сгорания горючих элементов.
- •Определение количества и состава продуктов сгорания при полном сгорании топлива
- •1.5 Температуры горения топлива
- •1.6 Коэффициент использования топлива
- •Раздел 2. Основы сжигания газообразного топлива
- •2.1 Общая характеристика процессов горения
- •2.2 Возникновение пламени
- •2.3 Диффузионный принцип сжигания
- •2.4 Кинетический принцип сжигания
- •2.5 Устройства для сжигания газа
- •Раздел 3. Жидкое топливо и его сжигание
- •3.1. Технические характеристики мазута
- •3.2 Основы сжигания жидкого топлива
- •3.2.1 Общие закономерности
- •3.2.2 Горение капли жидкого топлива
- •3.2.3 Сжигание жидких топлив в факеле
- •3. 2.4 Устройство для сжигания жидкого топлива (форсунки)
- •Литература
1.5 Температуры горения топлива
Под температурой горения понимают ту температуру, которую приобретают продукты сгорания в результате сообщения им тепла, выделяемого при сжигании. Различают адиабатную и действительную температуру горения. Адиабатной называется температура, которую приобретают продукты сгорания в адиабатных условиях, т.е. без теплообмена с окружающей средой. Действительной называется температура, которую приобретают продукты сгорания в реальных условиях сжигания.
Различают три адиабатные температуры: жаропроизводительность (по Д.И.Менделеееву), калориметрическая и теоретическая температуры.
Рассмотрим адиабатную оболочку, в которой находится 1 м3 газа или 1 кг жидкого топлива, или 1 кг твердого топлива. Внутри адиабатной оболочки находится стехиометрическое количество воздуха Lо, При подсчете жаропроизводительности принимают температуру топлива и воздуха равную 0 оС.
Составим
уравнение теплового баланса. С одной
стороны в адиабатной системе выделяется
![]() .
С другой стороны количество теплоты,
которое пошло на нагрев продуктов
горения Vпг
составляет
.
С другой стороны количество теплоты,
которое пошло на нагрев продуктов
горения Vпг
составляет
![]()
На основании теплового баланса
![]()
Из этого выражения следует, что максимальная температура, которую приобретают продукты горения, равна
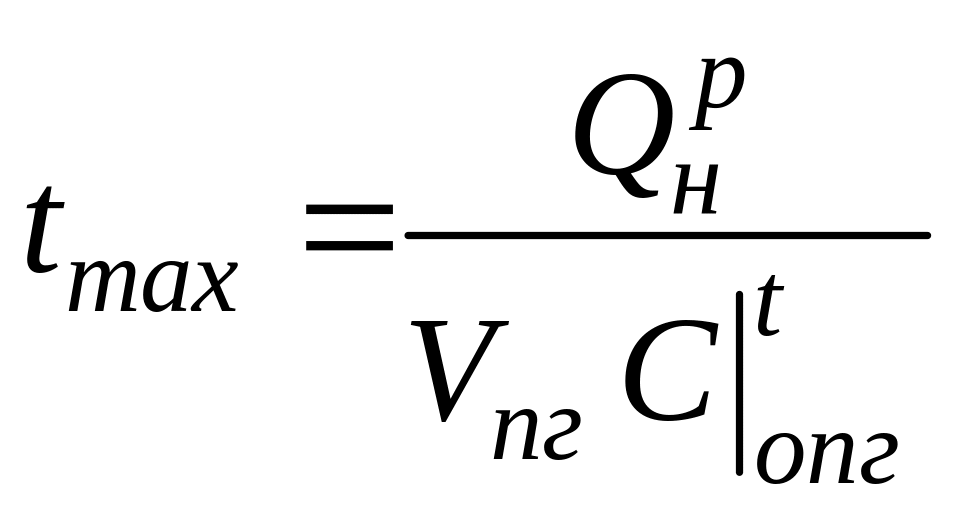 ,
оС
,
оС
где - низшая теплота сгорания, кДж/м3;
Vп.г - объем продуктов полного горения, полученный при
cтехиометрическом сжигании топлива, м3/м3, м3/кг;
![]() -
средняя объемная теплоемкость продуктов
горения,
-
средняя объемная теплоемкость продуктов
горения,
кДж/м3 К, кДж/кг К.
Полученная температура была названа Д.И.Менделеевым жаропроизводительностью топлива.
Полученную максимальную температуру в развернутом виде можно записать
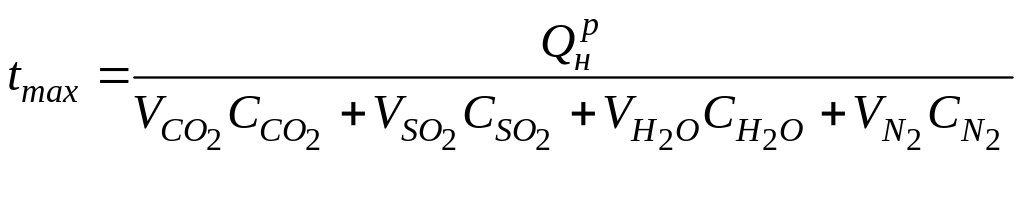 ,
оС
(1.29)
,
оС
(1.29)
Величина жаропроизводительности различных индивидуальных газов приведены в таблице 3.
Таблица 3 - Жаропроизводительность различных горючих газов
Газ |
Максимальное содержание СО2 при сжигании газа в воздухе, % |
Жаропроизводительность газа, оС |
Газ |
Максимальное содержание СО2 при сжигании газа в воздухе, % |
Жаропроизводительность газа, оС |
Метан Этилен Этан Пропилен Пропан Бутилен Бутан
|
11,8 15 13,2 15 13,8 15 14 |
2040 2280 2100 2225 2110 2200 2120 |
Пентан Водород Окись углерода Генераторный Коксовый Доменный Природный Попутный
|
14,2 - 34,7 20 10,5 25 11,8 13 |
2120 2235 2370 1750 2120 1500 2040 2030 |
Если при расчете температуры адиабатного горения учитывается подогрев воздуха и газа, то полученная температура называется калориметрической.
Тепловой баланс горения имеет вид
![]()
из которого следует
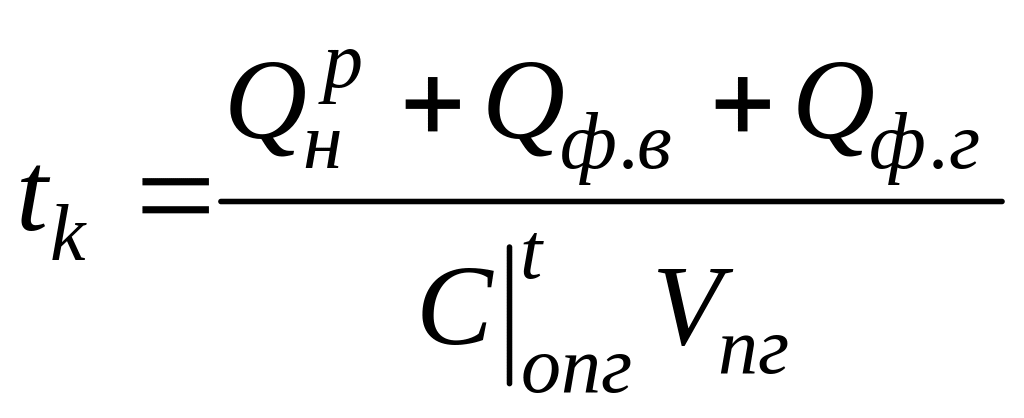 ,
(1.30)
,
(1.30)
где Qф.в. - физическое тепло подогретого воздуха, МДж/м3;
Qф.т - физическое тепло подогретого газа или жидкого топлива, МДж/м3.
Величину Qф.в. и Qф.г можно вычислить по формулам
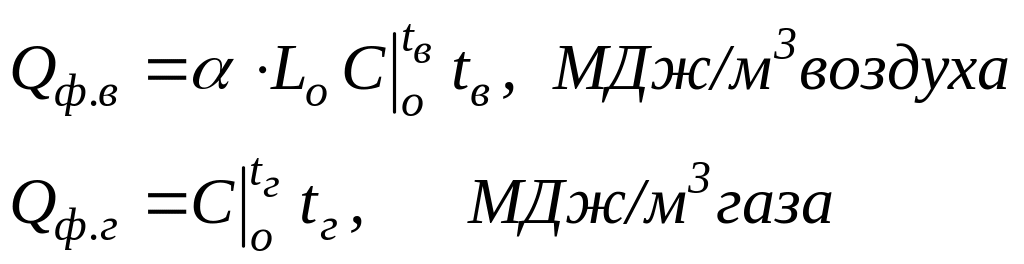 ,
,
где α - коэффициент расхода воздуха
Lо - теоретический расход воздуха, м3/м3;
![]() -
средняя объемная теплоемкость подогретого
воздуха
-
средняя объемная теплоемкость подогретого
воздуха
кДж/м3 К;
![]() -
средняя объемная теплоемкость подогретого
газа
-
средняя объемная теплоемкость подогретого
газа
кДж/м3 К;
tг, tв – температуры подогрева газа и воздуха
Величину Qф.в. и Qф.г можно записать и через энтальпии
![]()
Тогда tк можно записать в виде

Если левую и правую часть уравнения умножить на , то получим выражение калориметрической энтальпии
![]()
![]() (1.31)
(1.31)
Можно
записать в виде
![]()
Вычислить tк по представленным формулам невозможно, т.к. в формулу входит величина Спг, которая зависит от этой tк. Определяют tк двумя методами: 1) методом инерций; 2) графическим методом построения зависимости hп.г = f (t).
В соответствии с методом итераций задаемся калориметрической температурой t'к и вычисляем калориметрическую энтальпию h'к. Сравниваем hк и h'к . Если окажется, что h'к > hк, то следовательно принятая температура t'к завышена. Принимаем следующую температуру t''к на 100 о ниже, чем предыдущая и вновь рассчитываем h''к и сравниваем с hк. Необходимо достичь, чтобы hк находилась между h'к и h''к, тогда и калориметрическая температура будет находиться в диапазоне t'к и t''к. Калориметрическую температуру можно определить по интерпаляционной формуле
![]() ,
оС
,
оС
Калориметрическую
температуру можно определить графическим
путем. Для этого необходимо построить
зависимость
![]() продуктов горения по формуле
продуктов горения по формуле
![]() ,
,
где
![]() и
т.д. – энтальпия соответствующих
компонентов
и
т.д. – энтальпия соответствующих
компонентов
продуктов горения СО2, Н2О и т.д. – процентное содержа-
ние указанных компонентов в продуктах горения.
Затем вычисляется калориметрическая энтальпия продуктов горения
![]()
Откладывая hк на оси ординат hпг, проводится прямая параллельная оси абсцисс до пересечения с кривой энтальпии и из этой точки опускается на ось абсцисс, где и отмечается tк.
Калориметрическая температура рассчитывается из условий адиабатности и необратимости. В действительности реакции являются обратимыми и при температурах выше 1800 оС эндотермические реакции начинают оказывать ощутимое влияние. Адиабатическая температура, которая учитывает диссоциацию продуктов горения называется теоретической.
До температуры 2200 оС считается, что частичной диссоциации подвергаются только СО2 и Н2О
СО2
![]() СО +½ О2
- Qдисс
СО +½ О2
- Qдисс
Н2О
![]() Н2
+½ О2
- Qдисс
Н2
+½ О2
- Qдисс
Продукты горения в этом случае состоят из
СО – СО2 – Н2 - Н2О – N2
При подсчете температуры в печи при сжигании газов с высокой температурой сгорания, особенно при подогреве воздуха и газа, необходимо считаться с понижением температуры вследствие диссоциации продуктов сгорания
![]() ,
(1.32)
,
(1.32)
где
![]() -
теплота диссоциации продуктов сгорания,
образующихся при сгорании 1 кг или 1 м3
топлива, кДж/кг, кДж/м3.
-
теплота диссоциации продуктов сгорания,
образующихся при сгорании 1 кг или 1 м3
топлива, кДж/кг, кДж/м3.
Расчет теоретической температуры весьма трудоемкий, поэтому воспользуемся с достаточной для технических расчетов степенью точности зависимостями в области температур до
2200
оС
:
![]()
Величина φ равна:
1900 - 2000 оС φ = 0,96
2000 - 2100 оС φ = 0,945
2100 - 2200 оС φ = 0,93
При температуре выше 2200 оС происходит более глубокая диссоциация продуктов горения
СО2 СО +½ О2 - Qдис
Н2О Н2 +½ О2 - Qдис
Н2 Н + Н - Qдис
О2 О + О - Qдис
½N2 + ½ О2 NО - Q
Действительная температура горения tд соответствует реальным условиям сжигания и потерь тепловой энергии в печи
![]() ,
(1.33)
,
(1.33)
где qпот – потеря тепловой энергии в результате горения в реальных условиях, отнесенная к 1 м3 или 1 кг сжигаемого топлива
При рассмотрении понятия tд имеется в виду и теплопередача газов при этой температуре.
В связи со сложностью расчетов tд из-за qпот и qдисс было предложено использование пирометрического коэффициента ηпир. Отношение действительной температуры горения к калориметрической называется пирометрическим коэффициентом.
![]() (1.34)
(1.34)
Средние значения пирометрических коэффициентов для различных печей приведены в таблице 4.
Таблица 4- Средние значения пирометрических коэффициентов
Наименование печей и топок |
φ |
Кузнечная щелевая печь Камерная печь с плотно закрывающейся заслонкой Качественные садочные печи Мартеновская печь Методическая печь Туннельная печь закрытой конструкции Теплоизолированные печи неэкранированных котлов Топки экранированных котлов Стекловарочная печь непрерывного действия Шахтная печь для обжига цемента Воздухонагреватель |
0,66 – 0,7 0,75 – 0,8 0,80 – 0,85 0,70 – 0,75 0,70 – 0,75 0,75 – 0,82 0,70 – 0,75 0,65 – 0,7 0,70 – 0,75 0,75 – 0,8 0,77 – 0,9
|
Значение ηпир колеблется в пределах 0,6-0,85 для нагревательных печей. ηпир является эмпирической величиной, но можно вычислить и по формуле
![]() ,
(1.35)
,
(1.35)
где ε – КПД топочного процесса, доли единицы;
qпот и qпол - величина отдачи тепла продуктами сгорания нагреваемому материалу (полезная отдача) и различного рода потери.
