
- •Оглавление
- •Предисловие
- •Часть 1. Топливо и его сжигание
- •Раздел 1. Технические характеристики топлива
- •1.1 Топливо и его составные части
- •1.2 Теплота сгорания топлива.
- •Теплота сгорания твердого и жидкого топлива.
- •1.3 Условное топливо
- •1.4 Основы стехиометрического расчета горения топлива
- •Законы, лежащие в основе стехиометрических расчетов горения
- •1.4.2 Аналитический способ стехиометрических расчетов
- •Расход воздуха и выход продуктов полного сгорания горючих элементов.
- •Определение количества и состава продуктов сгорания при полном сгорании топлива
- •1.5 Температуры горения топлива
- •1.6 Коэффициент использования топлива
- •Раздел 2. Основы сжигания газообразного топлива
- •2.1 Общая характеристика процессов горения
- •2.2 Возникновение пламени
- •2.3 Диффузионный принцип сжигания
- •2.4 Кинетический принцип сжигания
- •2.5 Устройства для сжигания газа
- •Раздел 3. Жидкое топливо и его сжигание
- •3.1. Технические характеристики мазута
- •3.2 Основы сжигания жидкого топлива
- •3.2.1 Общие закономерности
- •3.2.2 Горение капли жидкого топлива
- •3.2.3 Сжигание жидких топлив в факеле
- •3. 2.4 Устройство для сжигания жидкого топлива (форсунки)
- •Литература
Определение количества и состава продуктов сгорания при полном сгорании топлива
Объем продуктов полного горения твердого или жидкого топлива складывается из СО2, Н2О, N2, SО2, О2 изб.
При полном сгорании твердого и жидкого топлива (при 1) объем СО2 в продуктов сгорания определяют по формулам
![]() =
0,01.
1,867 С, м3/кг,
=
0,01.
1,867 С, м3/кг,
где 1,867 – объем углекислого газа, полученный при полном
сгорании 1 кг углерода;
С – содержание углеводорода в топливе, %.
Объем водяных паров складывается :
из объема водяных паров, образовавшихся от сгорания 1 кг водорода топлива в количестве 22,4 : 2 = 11,2 м3/кг;
из объема водяных паров, полученных в результате испарения влаги топлива – 1,242 Wр , где 1,242 – удельный объем водяного пара (м3/кг);
при сжигании жидкого топлива его предварительно распыливают воздухом или паром; если обозначить через Wср (ср-средство распыления) количество пара (в кг), расходуемое для распыления 100 кг топлива, то количество пара в продуктах сгорания увеличится на 1,242 Wср (м3/кг).
Общее количество водяных паров в продуктах сгорания
![]() ,
м3/кг
(34)
,
м3/кг
(34)
При наличии серы в продуктах сгорания будет присутствовать сернистый газ. Из 1 кг серы получается 22,4: 32 = 0,7 м3.
Следовательно,
![]() =
0,01.0,7.Sр
=
0,01.0,7.Sр
![]() ,
м3кг
,
м3кг
Содержание азота в продуктах сгорания складывается из азота топлива 0,8 Nр, где 0,8 – удельный объем азота (22,4 : 28 =0,8) м3/кг, а так же азота в воздухе
где КО2 – объемная доля кислорода воздуха.
Следовательно, объем азота в продуктах сгорания
![]()
5. Объем избыточного кислорода воздуха
![]() ,
м3/м3
,
м3/м3
Общий объем продуктов сгорания (Vд) при сжигании твердого и жидкого топлива
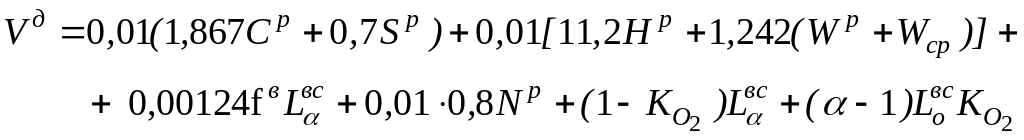 (1.27)
(1.27)
При сжигании газообразного топлива объем продуктов сгорания определяют по формулам
Объем углекислого газа
![]() ,м3/м3
,м3/м3
где СО, СО2 и т.д. – составляющие топлива, % (объема).
На 1 м3 СО получаем 1 м3 СО2 , поэтому при окислении углерода стоит коэффициент равный единице. При сгорании углеводородов СтНп количество молей СО2 в реакции получается равным количеству атомов углерода. Например, при сгорании СтНп получаем тСО2 и т.д. Общая формула для подсчета объема углекислого газа, полученного при полном сгорании углеводородов СтНп
![]()
Аналогично подставляют объем водяного пара, полученного при полном сгорании СтНп
![]()
2. Объем водяного пара
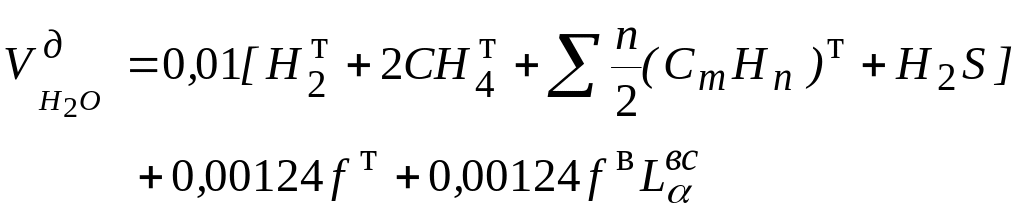 ,
м3/м3
,
м3/м3
где fт – влажность топлива, отнесенная к 1 м3 сухого газа, г/м3;
fв - влажность топлива, отнесенная к 1 м3 сухого воздуха, г/м3.
3. Объем SО2
![]() ,
м3/м3
,
м3/м3
4. Объем азота
![]() ,
м3/м3
,
м3/м3
5. Объем избыточного кислорода
![]() ,
м3/м3
,
м3/м3
6. Общий объем продуктов горения
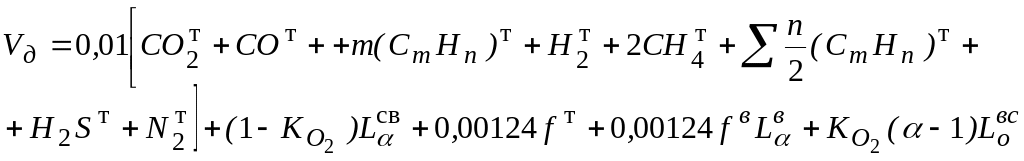 Пример
2 Определить
расход воздуха и выход продуктов сгорания
для сжигания 1 м3
газа следующего состава
Пример
2 Определить
расход воздуха и выход продуктов сгорания
для сжигания 1 м3
газа следующего состава
СН4 = 75 %; С2Н6 = 3 %; С3Н8 = 1 %; и СО2 = 21 %
Для горения 100 молей газа приведенного состава потребное количество кислорода составит
для горения метана СН4 по уравнению
СН4 + 2О2 = СО2 + 2Н2О 75 х 2 = 150 молей
2. для горения этана
С2Н6 + 3,5О2 = 2 СО2 + 3 Н2О 3 х 3,5 = 10,5 молей
3. для горения пропана
С3Н8 + 5 О2 = 3 СО2 + 4 Н2О 1 х 5 = 5 молей____
всего 165,5 молей
С этим количеством кислорода поступит азота
165,5 х 3,762 = 622,6 молей,
а всего воздуха 165,5 + 622 = 788,1 молей.
Следовательно, Lо = 788,1 : 100 = 7,881 моль/моль,
или Lо = 7,881 м3/м3
Определение состава продуктов горения
1. СО2
вносит газ 21 моль
- горение метана СН4 + 2О2 = СО2 + 2Н2О 75 х 1 = 75 молей
- горение этана С2Н6 + 3,5О2 = 2СО2 + 3Н2О 3 х 2 = 6 молей
- горение пропана С3Н8 + 5О2 =3СО2 + 4Н2О 1 х 3 = 3 моля_
всего 105 молей
2. Н2О
- горение метана СН4 + 2О2 = СО2 + 2Н2О 75 х 2 = 150 молей
- горение этана С2Н6 + 3,5О2 = 2СО2 + 3Н2О 3 х 3 = 9 молей
- горение пропана С3Н8 + 5О2 =3СО2 + 4Н2О 1 х 4 = 4 моля_
всего 163 моля
3. Воздух вносит азота 622,6 моля
Всего продуктов горения
Vд = 105 + 163 + 622,6 = 890,6 моля
Количество продуктов горения, образующихся на 1 м3 газа составит
Vд = 890,6 : 100 = 8,906 м3/м3
