
- •Оглавление
- •Предисловие
- •Часть 1. Топливо и его сжигание
- •Раздел 1. Технические характеристики топлива
- •1.1 Топливо и его составные части
- •1.2 Теплота сгорания топлива.
- •Теплота сгорания твердого и жидкого топлива.
- •1.3 Условное топливо
- •1.4 Основы стехиометрического расчета горения топлива
- •Законы, лежащие в основе стехиометрических расчетов горения
- •1.4.2 Аналитический способ стехиометрических расчетов
- •Расход воздуха и выход продуктов полного сгорания горючих элементов.
- •Определение количества и состава продуктов сгорания при полном сгорании топлива
- •1.5 Температуры горения топлива
- •1.6 Коэффициент использования топлива
- •Раздел 2. Основы сжигания газообразного топлива
- •2.1 Общая характеристика процессов горения
- •2.2 Возникновение пламени
- •2.3 Диффузионный принцип сжигания
- •2.4 Кинетический принцип сжигания
- •2.5 Устройства для сжигания газа
- •Раздел 3. Жидкое топливо и его сжигание
- •3.1. Технические характеристики мазута
- •3.2 Основы сжигания жидкого топлива
- •3.2.1 Общие закономерности
- •3.2.2 Горение капли жидкого топлива
- •3.2.3 Сжигание жидких топлив в факеле
- •3. 2.4 Устройство для сжигания жидкого топлива (форсунки)
- •Литература
2.2 Возникновение пламени
Возникновение пламени (воспламенение топлива) может произойти только после того, как будет достигнут необходимый контакт молекул топлива и окислителя. Любая реакция окисления протекает с выделением тепла. Вначале реакция окисления идет медленно с выделением малого количества тепла. Однако выделяющееся тепло способствует повышению температуры и ускорению реакции, что в свою очередь приводит к более энергичному выделению тепла, которое опять-таки оказывает благоприятное влияние на развитие реакции. Таким образом, происходит постепенное нарастание скорости реакции до момента воспламенения, после чего реакция идет с очень большой скоростью и носит лавинный характер. В реакциях окисления неразрывно связаны друг с другом механизм химической реакции и тепловые характеристики процесса окисления. Первичным фактором является химическая реакция и вторичным - выделение тепла. Оба эти явления тесно связаны между собой и влияют друг на друга.
Установлено, что воспламенение возможно как в изотермических условиях, так и при повышении температуры. В первом случае происходит так называемое цепное воспламенение, при котором скорость реакции нарастает в результате увеличения числа активных центров, возникающих только в результате химического взаимодействия. Чаще воспламенение происходит в неизотермических условиях, когда увеличение числа активных центров происходит в результате как химического взаимодействия, так и термического воздействия. В практических условиях обычно прибегают к искусственному поджиганию топлива, вводя в зону горения определенное количество тепла, что приводит к резкому ускорению момента достижения воспламенения.
Температура воспламенения не является физико-химической константой, определяемой только свойствами смеси; она определяется условиями протекания процесса, т. е. характером теплообмена с окружающей средой (температурой, формой сосуда и др.).
Температуры воспламенения различных топлив приведены в таблице 5.
Таблица. 5 - Температуры воспламенения в воздухе при атмо-
сферном давлении.
Вещество
|
Температура воспламенения, К |
Вещество |
Температура воспламенения, К |
||
минимальная |
макси- маль-ная |
минимальная |
макси- маль-ная |
||
Водород Окись углерода Метан Этан Пропан Бутан |
803 883 918 803 803 763 |
863 931 1123 867 861 842 |
Ацетилен Бензин Керосин Нефть Бурый уголь Кокс |
608 683 543 - - 873 |
773 833 593 498 723 973
|
Кроме температуры, большое влияние на процесс зажигания топлива оказывает концентрация горючей составляющей в смеси, Существуют такие минимальная и максимальная концентрации горючей составляющей, ниже и выше которых вынужденное воспламенение произойти не может. Такие предельные концентрации называются нижними и верхними концентрационными пределами воспламенения; значения их для некоторых газов приведены в таблице 6.
Таблица 6 - Пределы воспламенения в воздушных и кислородных смесях при атмосферном давлении и температуре 20оС
Горючий газ |
Химическая формула |
Концентрационные пределы восплаиенения в воздушных смесях, % газа по объему |
Концентрационные пределы восплаиенения в кислородных смесях, % газа по объему |
||
Водород Окись углерода Метан Этан Пропан Бутан Пентан Гексан Гептан Октан Этилен Ацитилен Бензол Метилов.спирт Этиловый спирт Сероуглерод Сероводород Водяной газ Коксовый газ Природный газ Доменный газ |
Н2 СО СН4 С2Н6 С3Н8 С4Н10 С5Н12 С6Н14 С7Н16 С8Н18 С2Н4 С2Н2 С6Н6 СН3ОН СН5ОН СS Н2S - - - - |
4 12,5 5 3,22 2,37 1,86 1,4 1,25 1,0 0,95 3,75 2,5 1,41 6,72 3,28 1,25 4,3 6,0 5,6 5,1, 35 |
74,2 74,2 15 12,45 9,5 8,41 7,8 6,9 6,0 - 29,6 80 6,75 36,5 18,95 50,0 45,50 70 28-30,8 12,1-25 65-73,9
|
4,65 15,5 5,4 4,1 2,3 1,8 - - - - 2,9 3,5 2,6 - - - - - - - - |
93,9 93,9 59,2 50,5 55 49 - - - - 79,9 89,4 30 - - - - - - - - |
Чтобы установить пределы воспламенения промышленных газов, которые являются смесью различных горючих компонентов, пользуются правилом Ле-Шателье, по которому
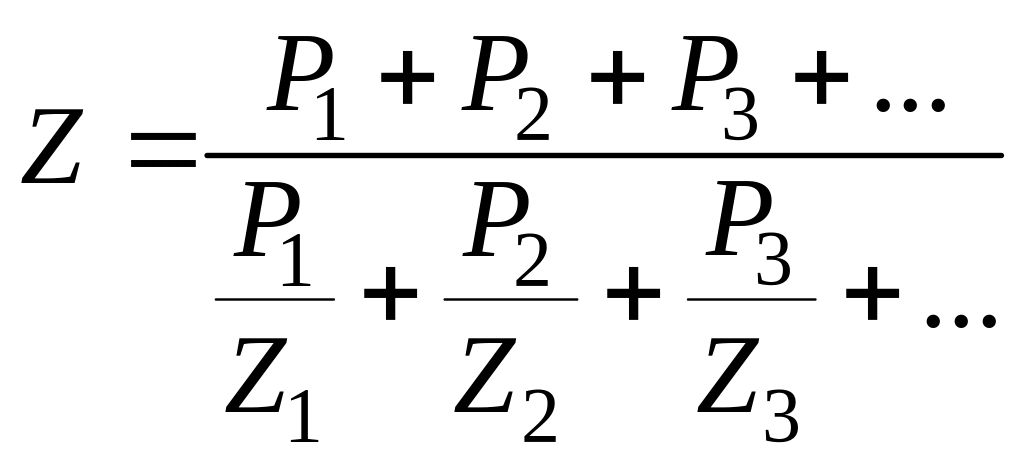 ,
(2.2)
,
(2.2)
где Z- искомый нижний или верхний предел воспламенения;
Z1; Z 2; Z 3 - соответствующие пределы воспламенения для горючих компонентов топлива;
Р1; Р2; Р3 - процентное содержание отдельных горючих компонентов в топливе.
Если газообразное топливо содержит балласт в виде СО2 и N2, то для определения пределов воспламенения применяют формулу
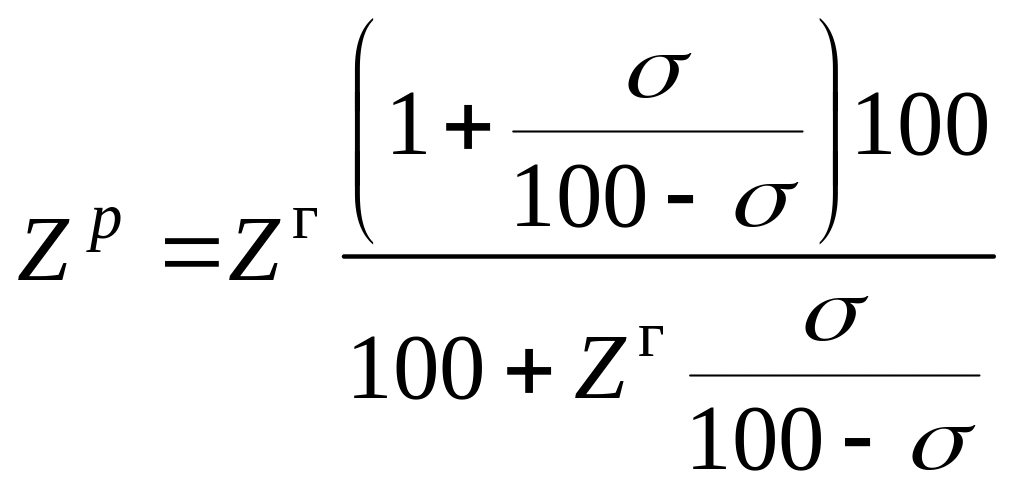 ,
(2.3)
,
(2.3)
где σ = СО+ N2 – содержание балласта в горючем газе, %;
Zг - пределы воспламенения, рассчитанные для горючей массы газа.
