
- •1) Задачи , содержание и роль физической и каллоидной химии
- •2) Агрегатное состояние вещества.Характеристика агрегатного состояния вещества.
- •Закон Авогадро-в равных объемах различных газов при одинаковых условиях содержится одинаковое число молекул.
- •6) Основные понятия и законы термодинамики.
- •Твердое состояние вещества.
- •9) Законы термохимии.
- •11) Химические равновесие.Принцип ле шаталье.
- •Химическое равновесие
- •12) Растворы. Характеристика.Растворимость.Закон генри.
- •13) Свойства растворов Законы вант гоффа и рауля.
- •14) Растворы электролитов. Электролическая диссоциация воды.
- •15) Электрохимия.Задачи и роль.
- •16) Коррозия металлов и методы борьбы с ней. Электролиз.
- •17) Сорбционные процессы. Виды поверхностных явлений.
- •25) Электрофорез и электроосмос.
- •26) Строение мицелл золей. Строение коллоидной мицеллы
- •29) Студни.
25) Электрофорез и электроосмос.
Электроосмос Направленное перемещение жидкости в пористом теле под действием приложенной разности потенциалов называется электроосмосом. Рассмотрим, например, электроосмотическое скольжение электролита в капилляре или порах мембраны. Примем для определенности, что на поверхности адсорбированы отрицательные ионы, которые закреплены неподвижно, а положительные ионы формируют диффузную часть ДЭС. Внешнее поле Е направлено вдоль поверхности. Электростатическая сила, действующая на любой произвольный элемент диффузной части ДЭС, вызывает движение этого элемента вдоль поверхности. Поскольку плотность заряда в диффузной части ДЭС Ф(х) меняется в зависимости от расстояния до поверхности х (рис. 1), разложенные слои жидкого электролита движутся с разными скоростями. Стационарное состояние (неизменность во времени скорости течения) будет достигнуто, когда действующая на произвольный слой жидкости электростатическая сила скомпенсируется силами вязкого сопротивления, возникающими из-за различия скоростей движения слоев жидкости, находящихся на разном удалении от поверхности. Уравнения гидродинамики, описывающие движение жидкости при постоянных вязкости жидкости и ее диэлектрической проницаемости м. б. решены точно, результатом решения является распределение скорости течения: Здесь- значение электрического потенциала на расстоянии от поверхности, где скорость течения жидкости обращается в нуль (т. наз. плоскость скольжения).
Электрофорез Направленное перемещение частиц дисперсной фазы под действием приложенной разности потенциалов называется электрофорезом. Электрофоретическое движение частиц в электролите имеет родственную электроосмосу природу: внешнее электрическое поле увлекает ионы подвижной части ДЭС, заставляя слои жидкости, граничащие с частицами, перемещаться относительно поверхности частиц. Однако в силу массивности объема жидкости и малости взвешенных частиц эти перемещения сводятся в отсутствие внешних сил к движению частицы в покоящейся жидкости. Для непроводящих частиц с плоской поверхностью в системах с тонкой диффузной частью ДЭС скорость электрофореза совпадает со скоростью электроосмотического скольжения, взятой с обратным знаком. Для проводящих сферических частиц скорость электрофореза м. б. рассчитана по уравнению: где- удельная электрическая проводимость частицы.
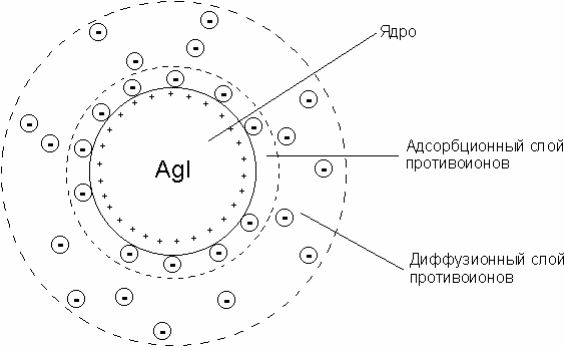
26) Строение мицелл золей. Строение коллоидной мицеллы
Лиофобные коллоиды обладают очень высокой поверхностной энергией и являются поэтому термодинамически неустойчивыми; это делает возможным самопроизвольный процесс уменьшения степени дисперсности дисперсной фазы (т.е. объединение частиц в более крупные агрегаты) – коагуляцию золей. Тем не менее золям присуща способность сохранять степень дисперсности – агрегативная устойчивость, которая обусловлена, во-первых, снижением поверхностной энергии системы благодаря наличию на поверхности частиц дисперсной фазы двойного электрического слоя и, во-вторых, наличием кинетических препятствий для коагуляции в виде электростатического отталкивания частиц дисперсной фазы, имеющих одноименный электрический заряд.
AgNO3 + KI ––> AgI + KNO3
27) Коагуляция гидрофобных золей.
Гидрофобные
дисперсные системы характеризуются
кинетической агрегативной устойчивостью,
определяемой скоростью процесса
коагуляции. Кинетика коагуляции
определяется уравнением Смолуховского:

где - суммарное число частиц дисперсной фазы ко времени τ;
- первоначальное число частиц; - время половинной коагуляции; ^ К – константа скорости коагуляции.
28) Высокомолекулярные соединения. Строение. Растворение и набухания
Растворы высокомолекулярных соединений (вмс)
Высокомолекулярными соединениями называются вещества, имеющие молекулярную массу от 10000 до нескольких миллионов а.е.м.
Размеры молекул ВМС в вытянутом состоянии могут достигать 1000 нм, т.е. соизмеримы с размерами частиц в коллоидных растворах и микрогетерогенных системах.
Температура кипения ВМС значительно выше температуры разложения, поэтому они существуют, как правило, только в жидком или твердом состоянии
Макромолекулы ВМС представляют собой гигантские образования, состоящие из сотен и тысяч атомов, химически связанных между собой.
Все ВМС по происхождению можно разделить на природные, образующиеся при биохимическом синтезе, и синтетические, получаемые искусственно путем полимеризации или поликонденсации.
В зависимости от строения полимерной цепи ВМС делятся на линейные, разветвленные и пространственные.
Подобно истинным растворам низкомолекулярных веществ растворы ВМС образуются самопроизвольно и являются термодинамически устойчивыми. В этом состоит их отличие от лиофобных коллоидных систем. Термодинамическая устойчивость обусловлена благоприятным соотношением энтальпийного и энтропийного факторов.
ВМС обладают рядом свойств, характерных для дисперсных систем: они способны образовывать ассоциаты, размер которых соизмерим с размерами частиц золей (1-100 нм), рассеивают свет, способствуют образованию эмульсий, суспензий и пен, для них характерны диффузия и броуновское движение. В то же время, в отличие от лиофобных золей в растворах ВМС отсутствует гетерогенность, т.е. нет большой межфазной поверхности.
Специфическим свойством, присущим только ВМС, является набухание при взаимодействии с растворителем. Набухание может быть ограниченным и неограниченным. Последнее приводит к растворению полимера.
Существует большое количество ВМС, которые в растворе диссоциируют с образованием высокомолекулярных ионов, они называются полиадектролитами. В зависимости от природы полимерных групп полиэлектролиты могут быть катионными, анионными и амфотерными. Последние содержат в своем составе одновременно кислотные и основные группы. В зависимости от рН среды они диссоциируют как кислоты или как основания. Состояние, при котором положительные и отрицательные заряды в молекуле белка скомпенсированы, называется изоэлектрическим, а значение рН, при котором молекула переходит в изоэлектрическое состояние, называется изо - электрической точкой белка (ИТБ).
