
- •Ф. М. Канарёв импульсная энергетика
- •Монографии начала физхимии микромира
- •Содержание
- •1. Элементы новой электродинамики……………………3
- •6. Вода-источник тепловой энергии………………90
- •7.Саяно-шушенский импульс……………………………122
- •1. Элементы новой электродинамики Вводная часть
- •1. 1. Электрон
- •1.2. Протон и нейтрон
- •1.3. Движение электронов вдоль проводов (Плюс – минус, юг-север)
- •1.4. Электроны в проводе с постоянным напряжением
- •1.5. Электроны в проводе с переменным напряжением
- •1.6. Энергия и мощность постоянного и переменного токов
- •1.7. Принципы работы электромоторов и электрогенераторов
- •1.8. Принцип работы диода
- •1.9. Зарядка диэлектрического конденсатора
- •1.10. Разрядка диэлектрического конденсатора
- •2. Глобальная физическая ошибка математиков
- •Новый закон формирования электрической мощности
- •3. Баланс мощности мотора-генератора
- •3.1. Теоретическая часть
- •3.3. Результаты контрольного эксперимента протокол
- •Результаты испытаний
- •4. Автономный источник энергии
- •Заключение
- •5. Вода – источник водорода и кислорода Вводная часть
- •5.1. Противоречия существующей теории электролиза воды
- •5.2. Новая теория электролиза воды и её экспериментальная проверка
- •5.3. Анализ процесса питания электролизёра
- •5. 4. Низкоамперный электролиз воды
- •5.5. Экспериментальная проверка гипотезы низкоамперного электролиза воды
- •Инструменты и оборудование, использованные при эксперименте
- •5.6. Вода, как источник электрической энергии Начальные сведения
- •5.7. Эффективность топливных элементов
- •Заключение
5. 4. Низкоамперный электролиз воды
Низковольтный
процесс электролиза воды известен со
времен Фарадея. Он широко используется
в современной промышленности. Рабочим
напряжением между анодом и катодом
электролизера является напряжение
1,6-2,3 Вольта, а сила тока достигает
десятков и сотен ампер. В соответствии
с законом Фарадея, затраты энергии на
получение одного кубического метра
водорода в этом случае составляют около
4 кВтч/![]() [40]. Минимальное напряжение, при котором
начинается процесс электролиза воды,
равно 1,23 В [49].
[40]. Минимальное напряжение, при котором
начинается процесс электролиза воды,
равно 1,23 В [49].
Возникает вопрос: как же идёт электролиз воды при фотосинтезе, когда явно отсутствует источник электроэнергии? Есть основания полагать, что при фотосинтезе молекула водорода выделяется из кластера воды (рис. 70, а и b) в синтезированном состоянии без использования электронов от постороннего источника электроэнергии.

Рис. 70. Схема формирования второй структуры молекулы ортоводорода в структуре кластера из двух молекул воды (0,485 eV – энергия разрыва кластера воды при её испарении)
Функцию первичного источника энергии при фотосинтезе выполняют фотоны, поглощаемые валентными электронами и ослабляющими связи между электронами молекулы ортоводорода и электронами гидроксилов , которые формируются в кластерах воды (рис. 70). В результате молекула ортоводорода выделяется из такого кластера в синтезированном состоянии (рис. 70, с).
После выделения молекулы ортоводорода из кластера воды электроны молекул ортоводорода вступают в связь с валентными электронами других атомов и образуются молекулы других химических соединений. Например, молекулы бензола (рис. 71).
Рис. 71. Структура молекулы бензола
В результате молекула водорода разделяется на атомы водорода в условиях отсутствия фазы свободного состояния атомов водорода, которые существуют в плазменном состоянии при температуре до 10000С.
В описанном
случае процесс выделения молекулы
водорода из кластеров молекул воды идёт
без электронов, получаемых из катода.
Именно этот процесс электролиза идёт
при фотосинтезе и мы попытаемся
смоделировать его в техническом
устройстве. А сейчас рассмотрим детали
процесса выделения молекул водорода
из кластера, состоящего из молекулы
воды![]() и иона
в электрическом поле электролизёра
(рис. 72).
и иона
в электрическом поле электролизёра
(рис. 72).
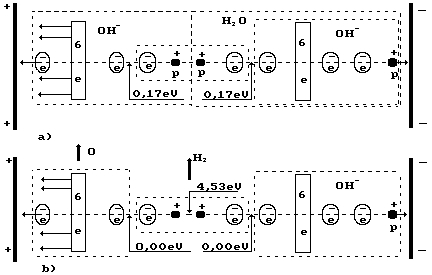
Рис. 72. Схема процесса низкоамперного электролиза
На рис. 72 показан
анод слева, а катод справа. Протон Р
атома водорода в молекуле воды ориентирован
к катоду, а другой протон этой молекулы
соединяется с протоном иона
![]() (слева).
В результате образуется кластерная
цепочка, с правой стороны которой
расположена молекула воды
(слева).
В результате образуется кластерная
цепочка, с правой стороны которой
расположена молекула воды
![]() (рис. 50), слева - ион
(рис.
52, а), а в центре - молекула ортоводорода
(рис. 50), слева - ион
(рис.
52, а), а в центре - молекула ортоводорода
![]() (рис. 53, а, b).
(рис. 53, а, b).
Обратим внимание на то, что осевой электрон атома кислорода и шесть кольцевых электронов иона притягиваются к аноду одновременно (рис. 72, а слева). Электростатические силы, притягивающие шесть кольцевых электронов к аноду, деформируют электростатическое поле так, что осевой электрон приближается к ядру атома кислорода, а шесть кольцевых электронов удаляются от ядра атома. В этом случае энергии связи между протонами и электронами в сформировавшейся таким образом молекуле водорода распределяются так, что энергия связи между атомами водорода в его молекуле увеличивается до 4,53 eV, а между электронами атомов кислорода в ионах и электронами атомов водорода становятся равными нулю и молекула водорода выделяется из кластерной цепочки. Два атома кислорода образуют его молекулу, и она также выделяется.
Таким образом, в
электролитическом растворе под действием
электростатического поля формируются
сложные кластерные цепочки со строгой
ориентацией между анодом и катодом
[41]. Под действием электрического поля
кластерная цепочка удлиняется,
одновременно изменяются и энергии связи
между элементами такой цепочки. Если
мы возьмём за основу результаты
эксперимента, приведенные на рис. 72, а,
то минимальная энергия (≈4 Вт), при
которой идет процесс электролиза,
приведенная к энергии связи (0,17 eV)
между электронами иона
![]() в цепочке (рис. 72, а) и молекулы воды,
оказывается порядка 0,17 eV.
Две таких связи дают энергию 0,34 eV,
что меньше энергии 0,485 eV
, при которой кластер из двух молекул
разрывается при испарении молекул воды.
Кроме этого, формирование молекулы
ортоводорода увеличивает энергию связи
между атомами водорода с 0,485 eV
до 4,53 eV.
Энергии связи 0,17 eV
(рис. 72, а) уменьшаются до нуля (рис. 72,
b)
и сформировавшаяся молекула ортоводорода
оказывается свободной.
в цепочке (рис. 72, а) и молекулы воды,
оказывается порядка 0,17 eV.
Две таких связи дают энергию 0,34 eV,
что меньше энергии 0,485 eV
, при которой кластер из двух молекул
разрывается при испарении молекул воды.
Кроме этого, формирование молекулы
ортоводорода увеличивает энергию связи
между атомами водорода с 0,485 eV
до 4,53 eV.
Энергии связи 0,17 eV
(рис. 72, а) уменьшаются до нуля (рис. 72,
b)
и сформировавшаяся молекула ортоводорода
оказывается свободной.
Конечно, это упрощенная схема. При более сложном процессе возможно формирование молекул перекиси водорода перед образованием молекулы кислорода. Именно к этому приводит малейшее нарушение оптимального сочетания параметров процесса электролиза.
Рассмотрим теперь реакции, протекающие у анода. Известно, что ион гидроксила (рис. 72, а), имея отрицательный заряд , движется к аноду (рис. 72, а). Два иона гидроксила, отдавая по одному электрону аноду и, соединяясь, друг с другом, образуют перекись водорода (рис. 72, b).
Известно, что процесс образования перекиси водорода эндотермический, а молекулы кислорода - экзотермический. При получении одного кубического метра водорода процесс образования перекиси водорода поглощает 22,32х109,00=2432,88 кДж. В силу этого даже при плазмоэлектролитическом процессе температура раствора в зоне анода остаётся низкой.
Если бы существовал процесс синтеза молекул кислорода, то при получении одного кубического метра водорода в зоне анода выделилось бы 22,32х495,00=11048,40 кДж. Вычитая из этой величины энергию, поглощенную при синтезе перекиси водорода, получим 11048,40-2432,88=8615,52 кДж. Складывая эту энергию с энергией синтеза молекул водорода 19463,00 кДж, получим 28078,52 кДж. В этом случае общий показатель тепловой энергетической эффективности должен быть таким =28078,52/14400=1,95. Поскольку в реальности этой энергии нет, то этот факт подтверждает гипотезу об отсутствии процесса синтеза молекул водорода в зоне катода и молекул кислорода в зоне анода при низковольтном электролизе. Молекула водорода (рис. 72, b) и атом кислорода (рис. 72, b) формируются в кластерных цепочках до выделения их в свободное состояние, поэтому и не генерируется энергия их синтеза.
После передачи двумя ионами гидроксила двух электронов аноду (рис. 72, а) образуется молекула перекиси водорода (рис. 72, b), которая, распадаясь, образует молекулу кислорода (рис. 72, с) и два атома водорода; последние, соединяясь с ионами гидроксила, образуют две молекулы воды (рис. 72, d,e). С учетом этого химическая реакция в зоне анода запишется так
(97)
А теперь опишем результаты экспериментов, показывающих связь, новой теории электролиза воды с реальностью.
